题目内容
5.乙酸的下列性质中,可以证明它是弱电解质的是( )| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 向CaCO3粉末中加入乙酸溶液有CO2气体生成 |
分析 根据弱电解质在溶液中部分电离进行分析,若测定一定浓度的弱酸溶液的pH,根据pH大小分析;测定强碱弱酸盐溶液的pH判断,注意水溶性、中和反应不能作为判断属于弱酸的依据.
解答 解:A、1 mol/L乙酸溶液的pH值约为2,证明溶液中乙酸部分电离出氢离子,属于弱电解质,故A正确;
B、乙酸能与水以任意比互溶,水溶性不能证明电解质的强弱,故B错误;
C、酸碱中和反应不能判断电解质的强弱,故C错误;
D、向CaCO3粉末中加入乙酸溶液有CO2气体生成,只能说明乙酸的酸性比碳酸强,但不能说明是弱酸,故D错误;
故选A.
点评 本题考查了强弱电解质的判断方法,题目难度不大,要求学生掌握强电解质和弱电解质的概念及判断方法.

练习册系列答案
相关题目
19.将质量百分比浓度为a%,物质的量浓度为C1 mol/L的稀硫酸蒸发掉一定量的水,使之质量百分比浓度为2a%,物质的量浓度为C2 mol/L,则C1和C2的关系是( )
| A. | C2=2C1 | B. | C2>2C1 | C. | C2<2C1 | D. | C1=2C2 |
16.某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2A?H++HA-,HA-?H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是( )
| A. | 0.01 mol/L的H2A溶液 | |
| B. | 0.01 mol/L的NaHA溶液 | |
| C. | 0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 | |
| D. | 0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |
13.如图为锌、铜和稀硫酸构成的原电池,下列说法不正确的是( )
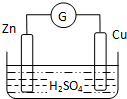

| A. | 外电路中电流由铜极流向锌极 | B. | 正极为电子流入的一极 | ||
| C. | 金属铜为负极 | D. | 发生还原反应的为正极 |
20.关于如图所示的原电池,下列说法不正确的是( )


| A. | 锌片发生氧化反应 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 铜片反应式为Cu2++2e-═Cu | D. | 该电池的反应本质是氧化还原反应 |
10. 某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是( )
某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是( )
 某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是( )
某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是( )| A. | Ⅱ氨水稀释时的pH变化曲线 | |
| B. | a、b、c三点溶液的导电性:c>b=a | |
| C. | a、b、c三点溶液中水的电离程度:c=b>a | |
| D. | a、b、c三点溶液Kw:c=b<a |
17.下列说法中正确的是( )
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |
14.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |
 .
.