题目内容
19.将质量百分比浓度为a%,物质的量浓度为C1 mol/L的稀硫酸蒸发掉一定量的水,使之质量百分比浓度为2a%,物质的量浓度为C2 mol/L,则C1和C2的关系是( )| A. | C2=2C1 | B. | C2>2C1 | C. | C2<2C1 | D. | C1=2C2 |
分析 物质的量浓度与溶质质量分数的关系为:c=$\frac{1000ρw}{M}$,且硫酸的浓度越大,硫酸溶液的密度越大,设出a%的硫酸溶液的密度为x、2a%的硫酸溶液的密度为y,则x<y,然后根据c=$\frac{1000ρw}{M}$及题中数据进行判断.
解答 解:设a%的硫酸溶液的密度为x、2a%的硫酸溶液的密度为y,则x<y,
则C1=$\frac{1000×x×a%}{98}$mol/L,C2=$\frac{1000×y×2a%}{98}$mol/L,
C1:C2=$\frac{1000×x×a%}{98}$mol/L:$\frac{1000×y×2a%}{98}$mol/L=$\frac{1}{2}$×$\frac{x}{y}$,
由于x<y,则$\frac{x}{y}$<1,则C1:C2<$\frac{1}{2}$,即:C2>2C1,
故选B.
点评 本题考查了溶质质量分数与物质的量浓度的关系、物质的量浓度的计算,题目难度中等,明确硫酸溶液密度与浓度的关系为解答关键,注意掌握溶质质量分数与物质的量浓度的转化关系.

练习册系列答案
相关题目
9.已知:2NO2 ?N2O4△H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )


| A. | (1)中红综色变深,(2)中红棕色变浅 | B. | (1)中红综色变浅,(2)中红棕色变深 | ||
| C. | 烧瓶(1)中气体的压强不变 | D. | 烧瓶(2)中气体的压强增大 |
7.某科研单位利用石油裂解的副产物CH4来制取CO和H2,其生产流程如图1:
(1)该流程第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2.(填“<”、“>”或“=”).该反应的平衡常数的表达式K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$.
(2)此流程的第Ⅱ步反应的平衡常数随温度的变化如表:
①从上表分析推断,该反应是△H<0(填“<”、“>”或“=”).
②在500℃时,设起始时CO和H2O的起始浓度均为0.010mol/L-1,在该条件下,反应达到平衡时,CO的转化率为75%.
③如图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).
(1)该流程第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2.(填“<”、“>”或“=”).该反应的平衡常数的表达式K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$.
(2)此流程的第Ⅱ步反应的平衡常数随温度的变化如表:
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |
②在500℃时,设起始时CO和H2O的起始浓度均为0.010mol/L-1,在该条件下,反应达到平衡时,CO的转化率为75%.
③如图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).

14.下列实验描述符合事实的是( )
| A. | 钠暴露在空气中,表面变暗,生成白色固体氧化钠 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色固体 | |
| C. | 铜的化学性质很稳定,铜在任何条件下都不会生锈 | |
| D. | 用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,剧烈燃烧火星四射,放出大量的热,生成红棕色的固体 |
4.关于钠的说法中正确的是( )
| A. | 钠是银白色、有一定延展性的金属,硬度很大 | |
| B. | 将钠放在石棉网用酒精灯加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| C. | 金属钠在空气中燃烧,因氧气浓度低,生成氧化钠 | |
| D. | 钠保存在煤油中,也可保存在CCl4中 |
11.下列离子方程式正确的是( )
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(OH)3溶液氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ |
5.乙酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 向CaCO3粉末中加入乙酸溶液有CO2气体生成 |
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.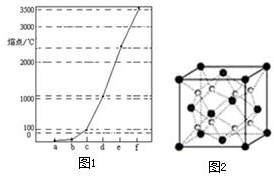 图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示:
图1中a~f分别表示有H、C、N、Na、Si、Cu元素组成的单质,其中c、d均是热和电的良导体,单质分别对应的熔点如图所示: