题目内容
10.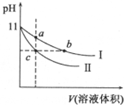 某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是( )
某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是( )| A. | Ⅱ氨水稀释时的pH变化曲线 | |
| B. | a、b、c三点溶液的导电性:c>b=a | |
| C. | a、b、c三点溶液中水的电离程度:c=b>a | |
| D. | a、b、c三点溶液Kw:c=b<a |
分析 根据信息可知氢氧化钠溶液和氨水具有相同的体积和pH,由于氢氧化钠是强电解质,则氢氧化钠的浓度小,再利用两溶液在稀释时强碱的变化程度来分析解答即可.
解答 解:A、由图可知,开始的pH相同,在稀释时由氨水的电离平衡可知,促进氨水的电离,则氨水中的离子浓度大,即I是氨水的pH变化曲线,故A错误;
B、由图可知,开始的pH相同,开始时氨水浓度大,稀释相同倍数,氨水的浓度仍然大,氨水中离子浓度也大,所以导电性a>c,对于氢氧化钠溶液,稀释后离子浓度减小,导电性变小,即a>b,故B错误;
C、由于氨水是弱电解质,氢氧化钠是强电解质,稀释相同倍数后,氨水的碱性强于氢氧化钠,所以氨水中水的电离程度小于氢氧化钠,而b、c两点的pH值相同,所以水电离的程度也相同,所以水的电离程度:c=b>a,故C正确;
D、Kw是温度的函数,a、b、c三点溶液温度相同,所以水的离子积常数不变,即c=b=a,故D错误;
故选:C.
点评 本题考查溶液稀释时PH的变化曲线图,明确强碱溶液在稀释时的PH的变化程度及相同pH时强碱的浓度比弱碱的浓度小是解答本题的关键.

练习册系列答案
相关题目
4.关于钠的说法中正确的是( )
| A. | 钠是银白色、有一定延展性的金属,硬度很大 | |
| B. | 将钠放在石棉网用酒精灯加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| C. | 金属钠在空气中燃烧,因氧气浓度低,生成氧化钠 | |
| D. | 钠保存在煤油中,也可保存在CCl4中 |
1.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L Na2CO3溶液:C(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] | |
| B. | 0.1 mol/L NH4Cl溶液:C(NH4+ )=C(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:C(Na+)>C(CH3COO-)>C(H+)>C(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:C(Na+)>C(NO3-) |
5.乙酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 向CaCO3粉末中加入乙酸溶液有CO2气体生成 |
15.现有部分短周期元素的性质或原子结构如下表:
(1)元素T在周期表中的位置是第三周期VIA族;
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数是原子核外电子层数的2倍 |
| X | 原子最外层电子数是次外层的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
19.某无色混合气体中可能含有Cl2、SO2、NO、NO2、N2中的一种或几种.现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色.下列对于原混合气体成分的判断中正确的是( )
| A. | 肯定有Cl2和SO2 | B. | 肯定有SO2和NO | C. | 可能有Cl2和N2 | D. | 肯定有SO2和NO2 |





 .
.