题目内容
8.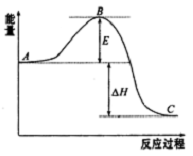 2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1请回答下列问题:
(1)图中A表示反应物总能量.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?降低加入V2O5后,上述反应△H不变(填变大、不变、变小)
(2)图中△H=-198kJ•mol-1.
(3)如果反应速率v(SO2)为0.06mol•L-1•min-1,则v(O2)为0.03 mol•L-1•min-1.
(4)已知S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,则由S(s)生成5mol SO3(g)的△H=-1975kJ•mol-1.
分析 (1)A、C分别表示反应物总能量的生成物总能量;催化剂能降低反应的活化能;催化剂对反应热无影响;
(2)参加反应SO2的物质的量之比等于对应的△H之比;
(3)反应速率之比等于方程式中计量数之比;
(4)利用盖斯定律计算求出S(s)生成 SO3(g)的热化学方程式,再求出生成5mol SO3(g)的△H.
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量;该反应通常用V2O5作催化剂,催化剂能降低反应的活化能;反应热由反应物的总能量与生成物的总能量的相对大小决定,与活化能的高低无关,所以加催化剂对反应热无影响;
故答案为:反应物总能量;降低;不变;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:-198;
(3)反应速率之比等于方程式中计量数之比,已知反应速率v(SO2)为0.06mol•L-1•min-1,则v(O2)=$\frac{1}{2}$v(SO2)=0.03mol•L-1•min-1;
故答案为:0.03;
(4)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ•mol-1,②SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H2=-99 KJ•mol-1;
则利用盖斯定律将①×3+②×3可得3 S(s)+$\frac{9}{2}$O2(g)=3SO3(g)△H3=3×(△H1+△H2)=-1185 KJ•mol-1,
所以生成5mol SO3(g)的△H=$\frac{5}{3}$×(-1185 KJ•mol-1)=-1975KJ•mol-1;
故答案为:-1975.
点评 本题综合考查反应热与焓变、反应速率的计算,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及盖斯定律的应用,题目难度中等.

| A. | 该元素的原子最外电子层上有6个电子 | |
| B. | 该元素最高正价氧化物的化学式为RO2 | |
| C. | 该元素一定是非金属元素 | |
| D. | 该元素最高价氧化物的对应水化物的化学式为H2RO4 |
| A. | Cl-离子的结构示意图: | B. | 白磷分子的比例模型: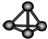 | ||
| C. | H2O2的结构式:H-O-O-H | D. | CCl4的电子式: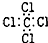 |
| A. | 1/5C2H2(g)+1/2O2(g)=2/5CO2(g)+1/5H2O(l)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)=0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol |
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
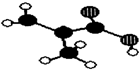 浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).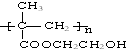 .
.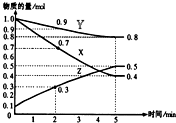 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.