题目内容
17.将8g Fe置于40mL HNO3中微热,生成气体的颜色随反应的进行由深变浅,充分反应后得标准状况下的气体为1.792L,此时剩余2.4g固体,求:(1)该反应中被还原的硝酸和未被还原的硝酸的质量比;
(2)求混合气体中NO和NO2的体积比.
分析 将8g铁粉置于40mlHNO3溶液中,发生的反应有:Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O,3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,
反应后铁过量,则继续发生:2Fe3++Fe=3Fe2+,最后得到溶液为Fe(NO3)2,反应的铁的质量为:8g-2.4g=5.6g,根据反应的有关方程式结合元素守恒铁以及电子守恒进行计算.
解答 解:(1)反应的铁的质量为:8g-2.4g=5.6g,则n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
将10g铁粉置于40mlHNO3溶液中,发生的反应有:Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O,3Fe+8HNO3(稀)=3Fe(NO3)2+NO↑+4H2O,反应后铁过量,则继续发生:2Fe3++Fe=3Fe2+,最后得到溶液为Fe(NO3)2,所以,未被还原的HNO3的物质的量为n(HNO3)=2n(Fe)=2×0.1mol=0.2mol,则被还原的硝酸的物质的量为:$\frac{1.792L}{22.4L/mol}$=0.08mol,所以该反应中被还原和未被还原的HNO3的物质的量之比为:0.08mol:0.2mol=2:5,等于质量之比.
答:该反应中被还原和未被还原的HNO3的质量之比为2:5;
(2)设混合气体中NO为xmol,NO2为ymol,则有:3x+y=2×0.1(电子守恒)x,x+y=0.08(N元素守恒),解得x=0.06mol.y=0.02mol.相同条件下,气体的物质的量之比等于体积之比,则NO、NO2体积比为3:1,答:NO、NO2体积比为3:1.
点评 本题考查化学方程式的有关计算,题目难度不大,注意有关反应方程式的书写,从守恒的角度解答.

①石油、煤、天然气、可燃冰、油脂都属于化石燃料
②石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
③淀粉、纤维素、蛋白质、蔗糖都是高分子化合物
④只用一种试剂可以实现乙醇、甲苯、溴苯三种试剂的鉴别
⑤甲烷、乙烯和苯在工业上都可通过石油的分馏得到
⑥人类借助扫描隧道显微镜,应用STM技术实现对原子或分子的操纵
⑦
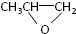 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物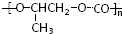 ,该反应符合绿化学的原则.
,该反应符合绿化学的原则.| A. | ①②③⑤ | B. | ①③④ | C. | ②④⑥⑦ | D. | ⑤⑥⑦ |
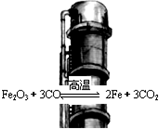
| A. | 升高温度,反应速率减慢 | |
| B. | 当反应达到化学平衡时,υ(正)=υ(逆)=0 | |
| C. | 提高炼铁高炉的高度可减少尾气中CO的浓度 | |
| D. | 某温度下达到平衡时,CO的体积分数基本不变 |
| A. | KAl(SO4)2 | B. | NH4Al(SO4)2 | C. | (NH4)2Fe(SO4)2 | D. | NH4Fe(SO4)2 |
| A. | 非金属元素的原子最外层电子数都大于或等于4 | |
| B. | 只有非金属能形成含氧酸或含氧酸盐 | |
| C. | Na2O2中阴阳离子的个数比为1:1 | |
| D. | 非金属元素组成的化合物不一定是共价化合物 |
| A. | AgCl水溶液的导电性很弱,所以AgCl是弱电解质 | |
| B. | 所有盐类都能促进水的电离 | |
| C. | 碳酸钠溶液加水稀释过程中,溶液中各离子浓度都减小 | |
| D. | 将1 mL pH=3的HX溶液稀释到10 mL,若溶液的pH<4,则HX为弱酸 |
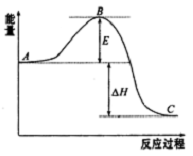 2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2 (g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1 )加氢产物1,2-二甲基环乙烷(
)加氢产物1,2-二甲基环乙烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )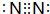 .
.