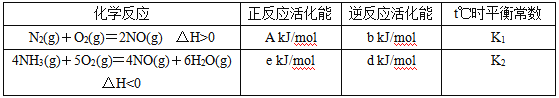
题目内容
【题目】高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
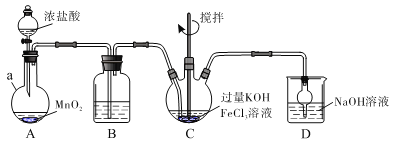
(1)仪器a的名称是____________,装置B中除杂质所用试剂是__________,装置D的作用是________________。
(2)A中发生反应的化学方程式为___________________________________。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为______,反应中KOH必须过量的原因是_____________________。
(4)写出C中总反应的离子方程式:__________________。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O![]() ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 (NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 (NH4)2Fe(SO4)2标准溶液28.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为__________。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_______(填“偏高”“偏低”或“无影响”)。
【答案】圆底烧瓶 饱和食盐水 吸收尾气Cl2并能防倒吸 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 冰水浴 K2FeO4在强碱性溶液中比较稳定 3Cl2+2Fe3++16OH-=2FeO42-+6Cl-+8H2O 92.4% 偏高
MnCl2+Cl2↑+2H2O 冰水浴 K2FeO4在强碱性溶液中比较稳定 3Cl2+2Fe3++16OH-=2FeO42-+6Cl-+8H2O 92.4% 偏高
【解析】
根据装置图:首先制得氯气,氯气中混有氯化氢,根据题目信息:K2FeO4强碱性溶液中比较稳定,故须用饱和的食盐水除去氯化氢,再通入三氯化铁和过量的氢氧化钾混合溶液中生成K2FeO4,氯气是有毒气体,需要氢氧化钠溶液吸收尾气。
(1)仪器a的名称是圆底烧瓶;HCl极易溶于水,饱和食盐水抑制氯气的溶解,又可除去氯气中的HCl,故装置B中除杂质所用试剂是饱和食盐水;装置D是用于吸收尾气Cl2,反应原理: Cl+2NaOH=NaCl+NaClO+HO,竖放干燥管能防倒吸,故装置D的作用是吸收尾气Cl2并能防倒吸;
(2)A中发生反应的化学方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为冰水浴降温;反应中KOH必须过量,由于题干所给信息:K2FeO4在强碱性溶液中比较稳定;
(4)根据氧化还原反应原理分析产物是FeO42-和Cl-,C中总反应的离子方程式:3Cl2+2Fe3++16OH-=2FeO42-+6Cl-+8H2O;
(5)足量CrCl3和NaOH溶液形成CrO2-,CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,得到定量关系为: 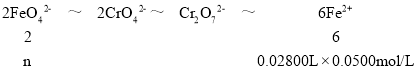
n=![]() ,250ml溶液中含有
,250ml溶液中含有![]() ×
×![]() =
=![]()
测定该样品中K2FeO4的质量分数=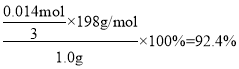
故答案为:92.4%;
若(NH4)2Fe(SO4)2标准溶液部分变质,所耗(NH4)2Fe(SO4)2的体积偏大,带入关系式的数据偏大,解得的K2FeO4的质量也就偏大,会使测定结果“偏高”。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案