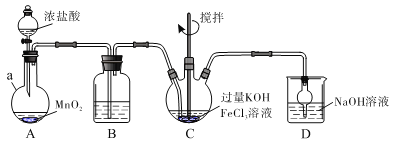
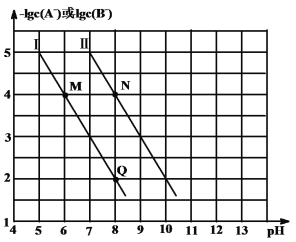
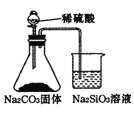
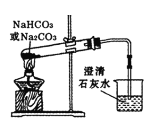
题目内容
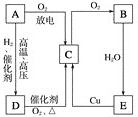
【题目】如图所示为 A、B、C、D、E 五种含同一元素物质之间的相互转化关系。其中A、B、C、D 在常温下都是气体,且 B 为红棕色气体。
(1)①A、D、E三种物质中从相同元素化合价的角度分析既具有氧化性又具有还原性是(填化学式)____________;
②写出B的化学式:_______________, D的一种常见用途 _____________;
(2)按要求写出下列化学方程式或离子方程式
①写出 E 的稀溶液与 Cu 反应的离子方程式:_______________________;
②写出 D 的实验室制法的化学方程式___________________。
【答案】N2 NO2 致冷剂 3Cu+8H++2![]() =3Cu2++2NO+ 4H2O 2NH4Cl+Ca(OH)2
=3Cu2++2NO+ 4H2O 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
【解析】
根据题干信息可知,B为红棕色气体,则B为NO2,C与氧气反应生成NO2,则C为NO;A气体在闪电条件下与氧气反应生成NO,则A为氮气(N2);E与铜反应生成NO,则E为硝酸(HNO3);D在催化剂条件下与氧气加热反应生成NO,且D是A在高温高压、催化剂条件下反应生成的,则D为氨气(NH3),据此分析解答。
(1)①根据上述分析可知,A为氮气(N2),其中N的化合价为0价,既可以升高又可以降低,D为氨气(NH3),其中N的化合价为最低价-3价,只能升高,E为硝酸(HNO3),其中N的化合价为最高价+5价,只能降低,因此三种物质中既具有氧化性又具有还原性的是N2;
②B为NO2,D为氨气(NH3),氨气易液化,常用作致冷剂;
(2)①Cu与稀硝酸反应生成硝酸铜、NO和H2O,其离子方程式为3Cu+8H++2![]() =3Cu2++2NO+ 4H2O;
=3Cu2++2NO+ 4H2O;
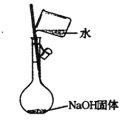
②实验室常用氯化铵和熟石灰(氢氧化钙)混合加热制取氨气,其化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。