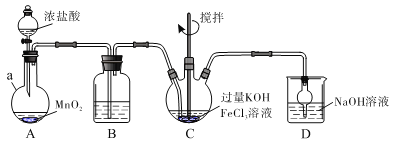
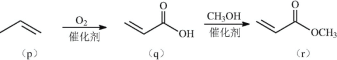
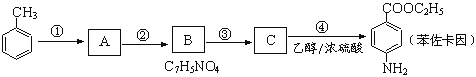
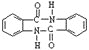
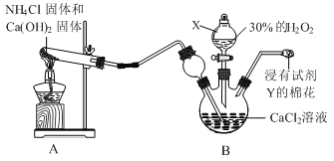题目内容
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
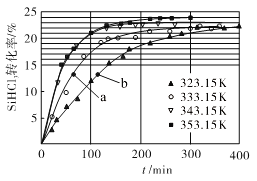
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
①353.15K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
③比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正=![]() ,v逆=
,v逆=![]() ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时![]() =________(保留3位小数)。
=________(保留3位小数)。
【答案】Si(s)+3HCl(g)=SiHCl3(g)+H2(g) H=-210kJ/mol SiCl4+LiAlH4=SiH4+LiCl+AlCl3 24% 0.025 吸热 改进催化剂 增大压强或提高反应物浓度 > 0.025
【解析】
(1)由盖斯定律,①-②得硅粉和氯化氢气体生产SiHCl3的热化学方程式:Si(s)+3HCl(g)=SiHCl3(g)+H2(g) H=-210kJ/mol;
(2)题目信息:四氯化硅和氢化铝锂(LiAlH4)反应后得甲硅烷及两种盐,氢化铝锂中有两种金属元素,刚好成两种盐LiCl、AlCl3 ,方程式为:SiCl4+LiAlH4=SiH4+LiCl+AlCl3;
(3)①由图可知353.15K时,最大转化率24%,则平衡转化率为24%;
反应的平衡常数计算:设起始SiHCl3浓度为1mol/L,根据三段式找到达到平衡各物质浓度,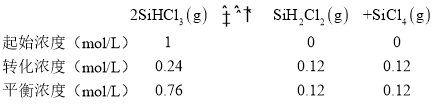
![]() ;
;
由图可知:温度升高,该平衡转化率增大,升温平衡正向移动,则正向是吸热反应。
②323.15K时,要缩短反应达到平衡的时间即加快反应速率,可采取的措施有改进催化剂、增大压强或提高反应物浓度;
③a、b两处转化率相同,说明消耗的SiHCl3等量的,但a的时间比b的短,a的反应速率快,故va>vb;
已知反应速率v正=![]() ,v逆=
,v逆=![]() ,达到平衡时v正=v逆,即
,达到平衡时v正=v逆,即![]() =
=![]() ,变形得
,变形得![]() =
=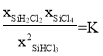 ,由图可知353.15K时,平衡转化率为24%,则在353.15K时
,由图可知353.15K时,平衡转化率为24%,则在353.15K时![]() =K=0.025。
=K=0.025。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案