题目内容
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
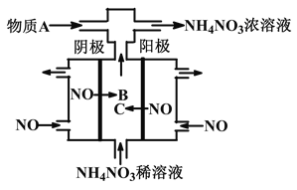
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
【答案】C
【解析】
A、阳极NO失电子发生氧化反应生成NO3-,电极反应式是:NO-3e-+2H2O=NO3-+4H+,故A错误;
B、阴极是NO得电子发生还原反应生成铵根离子,所以B是铵根离子,C是硝酸根离子,故B错误 ;
C、阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,因此若要使电解产物全部转化为NH4NO3,需补充NH3,故C正确;
D、电解过程中两个电极转移电离量一定相等,阴、阳两极转移的电子数之比为1∶1,故D错误;
故选C。

练习册系列答案
相关题目
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含KIO3 |
B | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: |
D | 室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 | 除去杂质FeCl3得纯净CuCl2溶液 |
A.AB.BC.CD.D