题目内容
【题目】A~G是几稱烃的分子球棍模型,据此回答下列问题:
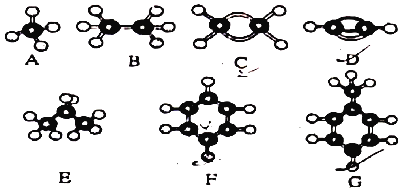
(1)能够发生加成反应的烃有_____(填数字)种;
(2)一卤代物种类最多的是_____ (填对应字母):
(3)写出一种区别F和G的方法(包括试剂和实验现象)_____
(4)写出F发生溴代反应的化学方程式_____。
【答案】4 G 取样,分别加入酸性高锰酸钾溶液,使高锰酸钾溶液褪色的是甲苯,不能使高锰酸钾溶液褪色的是苯 C6H6+Br2![]() C6H5Br+HBr
C6H5Br+HBr
【解析】
根据有机物的球棍模型分析有机物的种类;根据有机物的结构分析有机物的性质,书写相关反应方程式;运用等效氢法分析同分异构体的数目。
由结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯。
(1)能够发生加成反应的烃有乙烯、乙炔、苯和甲苯4种,故答案为:4;
(2)甲烷、乙烷、乙烯、乙炔、苯的一卤代物种类均为1种,丙烷的一卤代物两种,甲苯的一卤代物种类最多、有4种,故答案为:G;
(3)甲苯能与高锰酸钾溶液发生氧化反应,使高锰酸钾溶液褪色,苯与高锰酸钾溶液不反应,可用于区别甲苯和苯,故答案为:取样,分别加入酸性高锰酸钾溶液,使高锰酸钾溶液褪色的是甲苯,不能使高锰酸钾溶液褪色的是苯;
(4)在Fe催化作用下,苯与液溴发生取代反应生成溴苯,化学方程式为C6H6+Br2![]() C6H5Br+HBr,故答案为:C6H6+Br2
C6H5Br+HBr,故答案为:C6H6+Br2![]() C6H5Br+HBr。
C6H5Br+HBr。

【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400