题目内容
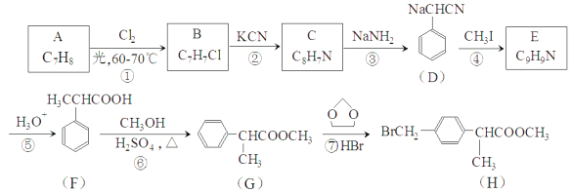
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
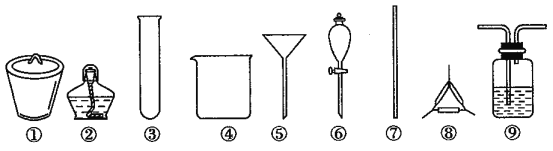
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
【答案】D
【解析】
A. 实验室通常用NH4Cl与Ca(OH)2固体在加热的条件下反应制取氨气,需要选用②③以及其他仪器,故A正确;
B. 从溶液中分离出NaHCO3固体需要过滤,选用④⑤⑦能够实现,故B正确;
C. 制取 Na2CO3是将NaHCO3加热使其分解,可选用①②⑦⑧,故C正确;
D. 制取 NaHCO3是将生成的氨气和二氧化碳通入饱和氯化钠溶液中,应先在⑨中通入氨气后再加入CO2,以增大CO2的溶解,故D错误。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下, SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。

2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。

①tl 时刻达到平衡后,改变一个条件使化学反应速率发生如下图所示的变化,则改变的条件是________。
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,n(SO3)的取值范围是_____________。