题目内容
9.在①NaCl、②NaOH、③Na2O2、④N2、⑤H2S、⑥H2O2中,只含有离子键的是NaCl,只含有极性键的是H2S,只含有非极性键的是N2,既含有离子键又含有极性键的是NaOH,既含有离子键又含有非极性键的是Na2O2.分析 金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,以此解答该题.
解答 解:NaCl中钠离子和氯离子之间只存在离子键;
NaOH中钠离子与氢氧根离子之间存在离子键,氧与氢之间存在极性共价键
Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;
N2中N原子之间只存在非极性共价键;
H2S分子中只含极性共价键;
H2O2中H原子和O原子之间只存在极性共价键,O与O原子之间为非极性键;
故答案为:NaCl;H2S;N2;NaOH;Na2O2.
点评 本题考查化学反应及化学键,为高频考点,把握化学键判断的一般规律分析化学键的断裂和形成为解答的关键,注重分析能力和基础知识的考查,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.下列分子中,所有碳原子一定在同一平面上的是( )
| A. | CH3-CH2-CH2-CH3 | B. | CH3-CH═CH-CH2-CH3 | ||
| C. | 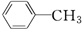 | D. | CH3-C≡C-CH3 |
20.下列描述中正确的是( )
| A. | 氮原子的价电子排布图: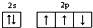 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第VA族,是p区元素 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 第一电离能和电负性:1s22s22p4>1s22s22p3 |
17.某烃和Cl2充分加成的产物其结构简式为 ,则原有机物一定是( )
,则原有机物一定是( )
 ,则原有机物一定是( )
,则原有机物一定是( )| A. | 2-丁炔 | B. | 2-甲基-1,4-二氯-2-丁烯 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二烯 |
4.下列混合物可用加热的方法分离的是( )
| A. | 碘和氯化铵 | B. | 硫酸钾和氯酸钾 | ||
| C. | 氯化铵和硫酸钡 | D. | 碳酸氢钠和碳酸氢铵 |
14.在反应容器中充人SO2 V1L和H2S V2L(标准状况下),充分作用后测知所得氧化产物比还原产物多1.6克,则以下推断一定错误的是( )
| A. | V1>1.12 V2>2.24 | B. | Vl+V2≥3.36 | ||
| C. | 若Vl=1.12,则V2≥2.24 | D. | 若V1≥1.12,则V2=2.24 |
1.下列属于纯净物的是( )
| A. | 汽油 | B. | 煤 | C. | 乙烯 | D. | 石油裂解气 |
18.下列烃的含氧衍生物中,只能与金属钠反应,不与碳酸氢钠溶液反应的是( )
| A. | CH2=CHCHO | B. | 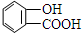 | C. | CH3COOCH3 | D. | 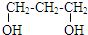 |
19.根据如表五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
(1)在周期表中,最可能处于同一族的是E
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.