题目内容
20. 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因可能是abd填序号).
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
c.量取盐酸的体积时仰视读数
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
Ⅱ.酸碱中和滴定.
(1)某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.实验中不必用到的是a
a.容量瓶 b.铁架台 c.锥形瓶 d.酸式滴定管
(2)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且半分钟不褪色,即停止滴定.
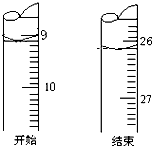
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为9.00mL,终点读数为26.10mL.已知用c(HCl)=1.0×10-2mol/L的盐酸标定25mL的氢氧化钠溶液,测得c(NaOH)0.0068mol/L
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是ad(填序号).
a.碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液
b.锥形瓶用蒸馏水洗净后没有干燥
c.酸式滴定管在滴定前有气泡,滴定后气泡消失
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数.
分析 Ⅰ.(1)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(2)a.装置保温、隔热效果差,测得的热量偏小;
b.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多;
c.量取盐酸的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高;
Ⅱ.(1)根据中和滴定实验的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由红色突变为无色;
(3)根据滴定管的结构和精确度以及测量的原理:NaOH+HCl=NaCl+H2O来解答;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:Ⅰ.(1)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,则稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,中和热的数值偏小,故b正确;
c.量取盐酸的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故c错误;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故d正确;
故选abd;
Ⅱ.(1)中和滴定实验的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台,实验中不必用到的是容量瓶,故选a.
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由红色突变为无色,且半分钟内不褪色,且半分钟内不褪色,
故答案为:锥形瓶中溶液颜色的变化;红;无;
(3)起始读数为9.00mL,终点读数为26.10mL,消耗的盐酸溶液的体积为17.10mL,用c(HCl)=1.0×10-2mol/L的盐酸标定25mL的氢氧化钠溶液,发生NaOH+HCl=NaCl+H2O,则满足V(HCl)×c(HCl)=V(NaOH)×c(NaOH),c(NaOH)=$\frac{1.0×1{0}^{-2}mol/L×17.10mL}{25mL}$=0.0068mol/L;
故答案为:9.00;26.10;0.0068;
(4)a、碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液,待测液的浓度偏小,物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏小,故a错误;
b、锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)无影响,故b错误;
c、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏大,故c错误;
d、读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定c(NaOH)偏低,故d正确;
故答案为:ad.
点评 本题主要考查了中和滴定操作与误差分析,侧重于学生的分析、实验和计算能力的考查,难度不大,注意中和滴定的原理、酸碱中和时H+的物质的量与OH-离子的物质的量相等,把握误差分析.

| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内O2、NO、NO2的浓度之比为1:2:2 | |
| D. | 单位时间内生成1mol O2,同时生成0.2mol NO2 |
| A. | 增大反应物用量 | B. | 使用催化剂 | C. | 增大体系压强 | D. | 升高温度 |
| A. | 向红褐色的Fe(OH)3固体中加入过量盐酸 | |
| B. | 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液 | |
| C. | 等物质的量的NaHCO3与Na2O2固体 | |
| D. | 向NaBr溶液中通入过量氯气 |
| A. | 0.5 mol | B. | 0.95 mol | C. | 0.67 mol | D. | 1 mol |
| A. | Ca(HCO3)2溶液中加入过量NaOH溶液Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | SO2通入溴水中SO2+Br2+2H2O═4H++2Br-+SO42- | |
| C. | 泡沫灭火器原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| D. | FeO与稀HNO3反应FeO+2H+═Fe2++H2O |
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2 | |
| B. | 晶体硅可以制作太阳能电池板 | |
| C. | 自来水厂可用氯气来杀菌消毒,因此氯气无毒 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液 |
 N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )