题目内容
8.对于任何一个平衡体系,采用下列措施一定会使平衡移动的是( )| A. | 增大反应物用量 | B. | 使用催化剂 | C. | 增大体系压强 | D. | 升高温度 |
分析 A、对于固体参加的反应,增大反应物用量,平衡不移动;
B、使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动;
C、对于有气体参加的反应前后气体体积变化的反应,压强会引起平衡的移动;
D、升高温度,化学平衡向着吸热方向进行,任何化学反应一定伴随能量的变化.
解答 解:A、对于固体参加的反应,增大反应物用量,平衡不移动,故A错误;
B、使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动,故B错误;
C、对于没有气体参加的反应,或是前后气体体积不变的反应,压强不会引起平衡的移动,故C错误;
D、任何化学反应一定伴随能量的变化,升高温度,化学平衡一定是向着吸热方向进行,故D正确.
故选D.
点评 本题考查学生影响化学平衡移动的因素,注意每个因素的使用情况是解答的关键.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒 容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 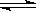 2NH3(g)
2NH3(g) 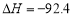 kJ·mol
kJ·mol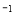 )
)
容器 | 甲 | 乙 | 丙 |
| 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
请写出下列物理量的关系:
(1)浓度c1与c2_________________;2c2与c3________________
(2)能量a与b __________________;2b与c___________________
(3)压强p1与p2_________________;2p2与p3__________________
(4)转化率α1与α2________________;α2与α3___________________
Ⅰ四种制取Cu2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu2O;
(b)用葡萄糖还原新制的Cu(OH)2悬浊液制备Cu2O;
(c)电解法制备Cu2O.原理如右图所示反应为:2Cu+H2O=Cu2O+H2↑,则铜作为阳极;
(d)最新实验研究加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2和水蒸气.该制法的化学方程式为4Cu(OH)2+N2H4 $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O.
Ⅱ用制得的Cu2O进行催化分解水的实验Cu2O光照
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:
2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1
T1温度下不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
(2)用以上四种方法制得的Cu2O在某相同条件下分别对四份 相同质量的水催化分解,
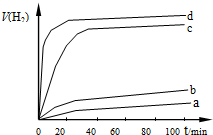 产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).A.d方法制得的Cu2O能使水剧烈分解并放出热量
B.d方法制得的Cu2O颗粒最小,表面活性大,所以催化效果明显.
C. c、d 产生的氢气总体积不同可能和水的蒸发有关
D. d方法制得的Cu2O作催化剂时,水的平衡转化率最高.
| A. | 该反应熵判据起决定作用 | B. | 该反应焓判据起决定作用 | ||
| C. | 该反应是熵减的反应 | D. | 该反应是分解反应 |
 反应物投入量
反应物投入量 2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )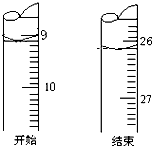 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.