题目内容
15.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是( )| A. | 向红褐色的Fe(OH)3固体中加入过量盐酸 | |
| B. | 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液 | |
| C. | 等物质的量的NaHCO3与Na2O2固体 | |
| D. | 向NaBr溶液中通入过量氯气 |
分析 A.Fe(OH)3固体中加入过量盐酸反应生成氯化铁,氯化铁水解生成氢氧化铁沉淀和氯化氢,盐酸挥发,氢氧化铁分解最终得到氧化铁;
B.等物质的量的硫酸铵和氯化钡反应生成硫酸钡和氯化铵,氯化铵受热分解;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应;
D.向NaBr溶液中通入过量氯气反应生成NaCl、溴,溴易挥发.
解答 解:A.向红褐色的Fe(OH)3固体中加入过量盐酸反应生成氯化铁,氯化铁会水解得到氢氧化铁和盐酸,盐酸挥发,灼烧氢氧化铁分解最终得到氧化铁,为纯净物,故A错误;
B.等物质的量的浓度、等体积的(NH4)2SO4与BaCl2溶液,反应生成硫酸钡和氯化铵,氯化铵分解生成氨气和HCl,氯化氢、氨气挥发,蒸干灼烧后的固体为硫酸钡,为纯净物,故B错误;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应,蒸干灼烧后的固体为碳酸钠和NaOH,为混合物,故C正确;
D.向NaBr溶液中通入过量氯气反应生成NaCl、溴,溴易挥发,蒸干灼烧后的固体为NaCl,为纯净物,故D错误;
故选:C.
点评 本题考查了元素化合物的性质,明确发生的化学反应及物质的性质是解答本题的关键,题目难度中等,注意盐类水解的应用.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
3.科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
Ⅰ四种制取Cu2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu2O;
(b)用葡萄糖还原新制的Cu(OH)2悬浊液制备Cu2O;
(c)电解法制备Cu2O.原理如右图所示反应为:2Cu+H2O=Cu2O+H2↑,则铜作为阳极;
(d)最新实验研究加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2和水蒸气.该制法的化学方程式为4Cu(OH)2+N2H4 $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O.
Ⅱ用制得的Cu2O进行催化分解水的实验Cu2O光照
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:
2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1
T1温度下不同时段产生O2的量见下表:
前20min的反应速率 v(H2O)=5.0×10-5 mol.L-1.min -1;该该温度下,反应的平衡常数的表达式K=$\frac{{c}^{2}({H}_{2})•c({O}_{2})}{{c}^{2}({H}_{2}O)}$;若T2温度下K=0.4,T1>T2(填>、<、=)
(2)用以上四种方法制得的Cu2O在某相同条件下分别对四份 相同质量的水催化分解,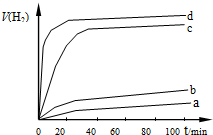 产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
A.d方法制得的Cu2O能使水剧烈分解并放出热量
B.d方法制得的Cu2O颗粒最小,表面活性大,所以催化效果明显.
C. c、d 产生的氢气总体积不同可能和水的蒸发有关
D. d方法制得的Cu2O作催化剂时,水的平衡转化率最高.
Ⅰ四种制取Cu2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu2O;
(b)用葡萄糖还原新制的Cu(OH)2悬浊液制备Cu2O;
(c)电解法制备Cu2O.原理如右图所示反应为:2Cu+H2O=Cu2O+H2↑,则铜作为阳极;
(d)最新实验研究加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2和水蒸气.该制法的化学方程式为4Cu(OH)2+N2H4 $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O.
Ⅱ用制得的Cu2O进行催化分解水的实验Cu2O光照
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:
2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1
T1温度下不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
(2)用以上四种方法制得的Cu2O在某相同条件下分别对四份 相同质量的水催化分解,
 产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).A.d方法制得的Cu2O能使水剧烈分解并放出热量
B.d方法制得的Cu2O颗粒最小,表面活性大,所以催化效果明显.
C. c、d 产生的氢气总体积不同可能和水的蒸发有关
D. d方法制得的Cu2O作催化剂时,水的平衡转化率最高.
4.a的金属活动性比氢强,b为碳棒,关于下列装置的说法中不正确的是( )
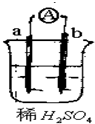

| A. | a发生氧化反应,b发生还原反应 | B. | 碳棒上有气体逸出 | ||
| C. | 导线上有电流,电流方向从a→b | D. | 反应后a极质量减小 |
5.配制一定物质的量浓度的溶液一般可分为以下几个步骤:①称量(或量取)②计算溶质的量③溶解④摇匀⑤转移溶液(包括洗涤)⑥定容⑦注入试剂瓶贴标签.其正确的操作顺序是( )
| A. | ②①③⑤④⑥⑦ | B. | ②①③⑤⑥④⑦ | C. | ②①⑤③⑥④⑦ | D. | ①②③⑤⑥④⑦ |
 2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )
 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.