题目内容
5.密闭容器中存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),当充入1mol CO和1mol水蒸气,达到平衡时生成了0.67molCO2,当充入的水蒸气改为4mol,其它条件不变,平衡时生成的CO2的物质的量可能为( )| A. | 0.5 mol | B. | 0.95 mol | C. | 0.67 mol | D. | 1 mol |
分析 增大反应物浓度,平衡正向移动;结合可逆反应的特点进行判断.
解答 解:CO+H2O(g)?CO2+H2,
开始 1 1 0 0
平衡 0.33 0.33 0.67 0.67,
增大水蒸气的浓度,平衡正向移动,但CO不可能完全转化,故平衡时CO2的物质的量的取值范围为:0.67<n(CO2)<1,
故选B.
点评 本题考查可逆反应的特点及化学平衡的移动,难度不大.注意可逆反应中,反应物的转化率不可能是100%,利用极限法计算.

练习册系列答案
相关题目
13.在25℃和1.01×105Pa时,反应(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol能自发进行的合理解释( )
| A. | 该反应熵判据起决定作用 | B. | 该反应焓判据起决定作用 | ||
| C. | 该反应是熵减的反应 | D. | 该反应是分解反应 |
10.下列对化学反应的认识正确的是( )
| A. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 反应物的总焓大于生成物的总焓时,△H>0 |
 质子数为10 NA
质子数为10 NA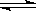 2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )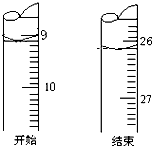 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.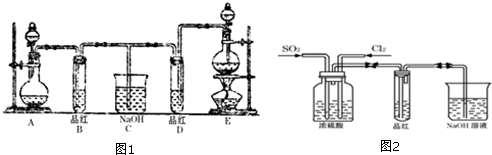
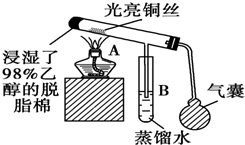 有关催化机理等问题可从“乙醇催化氧化实验”得到一些认识,实验装置如图所示.其实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部分加热,片刻后开始有节奏地鼓入空气,即可观察到明显的实验现象.请回答以下问题:
有关催化机理等问题可从“乙醇催化氧化实验”得到一些认识,实验装置如图所示.其实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部分加热,片刻后开始有节奏地鼓入空气,即可观察到明显的实验现象.请回答以下问题: