题目内容
3. (1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形
(1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形(2)[Cu(NH3)4]SO4属于配合物,其中N原子提供孤对电子.配合物Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,Fe(CO)5晶体属于分子晶体(填晶体类型).
(3)金属铜晶体的晶胞结构如图所示(面心立方晶胞):
若该晶胞边长为dnm,铜的相对原子质量为64,阿伏加德罗常数为NA,则该晶体的密度为$\frac{4×64}{{N}_{A}(d×1{0}^{-7})^{3}}$g/cm3.(列表达式)
分析 (1)根据NF3分子中N原子的价层电子对数判断杂化轨道类型,根据价层电子对互斥理论确定NF3空间构型;
(2)[Cu(NH3)4]SO4属于配合物,所以金属阳离子提供空轨道,配体提价孤电子对,分子晶体熔沸点低,比较易溶于非极性溶剂;
(3)根据均摊法可知,该晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$可计算得密度;
解答 (1)根据价层电子对理论知,NF3分子中N原子价层电子对个数=$\frac{5+3}{2}$=4,所以N原子采用sp3杂化,氮原子周围有一个孤电子对,所以其空间构型为三角锥形,
故答案为:sp3;三角锥形;
(2)[Cu(NH3)4]SO4属于配合物,金属阳离子提供空轨道,氨分子是配体提价孤电子对,所以氨分子中的氮原子提价孤电子对,Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,可知Fe(CO)x属于分子晶体,
故答案为:N;分子晶体;
(3)根据均摊法可知,该晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,晶胞的体积为(d×10-7cm)3,所以密度为$ρ=\frac{m}{V}$=$\frac{\frac{4×64}{{N}_{A}}}{(d×1{0}^{-7})^{3}}$g/cm3=$\frac{4×64}{{N}_{A}(d×1{0}^{-7})^{3}}$g/cm3,
故答案为:$\frac{4×64}{{N}_{A}(d×1{0}^{-7})^{3}}$;
点评 本题主要考查原子结构与位置关系、杂化轨道、分子空间构型、晶体类型与性质、晶胞结构与计算等,注意利用均摊法进行计算,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.一定质量的下列各组物质的混合物,不管两者以何种质量比混合,充分燃烧后所生成的H2O的质量都相等,该混合物可能是( )
| A. | 乙醇和乙烯 | B. | 甲醛和葡萄糖 | C. | 乙烯和乙酸乙酯 | D. | 丙烷和乙醛 |
14.已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
11.下列各组物质中,都是共价化合物的是( )
| A. | H2O2和CaF2 | B. | H2S和Na2O2 | C. | HNO3和HClO4 | D. | NH3和N2 |
18.在可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大CO浓度 |
5.下列关于反应:XeF4+2CH3-CH=CH2?→2CH3CH2-CHF2+Xe的说法正确的是( )
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |
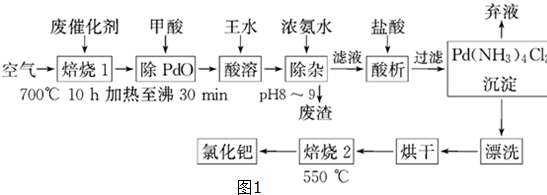

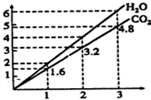 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )