题目内容
11.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )| A. | 将水加热煮沸 | B. | 向水中投入一小块金属钠 | ||
| C. | 向水中通入二氧化硫气体 | D. | 向水中加食盐晶体 |
分析 c(H+)>c(OH-),溶液呈酸性,再根据影响水的电离的因素:温度、同离子效应、所加物质的酸碱性等具体分析水的电离平衡的移动.
解答 解:A、加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,故A错误;
B、加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,氢离子浓度降低,使水的电离向右移动,碱性增强,c(H+)<c(OH-),故B错误;
C、二氧化碳溶于水形成碳酸,溶液中的c(H+)>c(OH-),酸对水的电离起抑制作用,故C正确;
D、食盐在水中电离出钠离子与氯离子,两者都不能结合水电离的氢离子或氢氧根离子,不能使氢离子或氢氧根离子浓度变化,平衡不一定,不影响水的电离,溶液呈中性,故D错误,
故选C.
点评 本题考查学生水的电离的影响因素,酸碱均抑制水的电离,较简单.

练习册系列答案
相关题目
1.某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验.
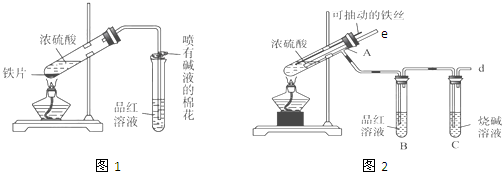
(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:

(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色有明显变化,则说明Ⅱ成立. (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立. |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性高锰酸钾溶液 | 如果滴加酸性高锰酸钾溶液后溶液的紫红色褪色,则说明溶液中含有亚铁离子,说明Ⅲ成立;如果滴加酸性高锰酸钾溶液后溶液紫红色不褪,则说明溶液中没有亚铁离子,说明Ⅰ成立. |
6.在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3•nH2O ⑤杂质碳被氧化.
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3•nH2O ⑤杂质碳被氧化.
| A. | 只有①和② | B. | 只有②③④ | C. | ①②③④ | D. | ①②③④⑤ |
16.今年是我国科学家成功合成牛胰岛素50周年.1965年,中国科学院上海生物化学研究所、北京大学和的科学家通力合作在世界上第一次用人工方法合成出具有生物活性的蛋白质--结晶牛胰岛素.下列有关说法不正确的是( )
| A. | 人工牛胰岛素的合成,标志着人类在化学合成技术上迈出了重要的一步 | |
| B. | 牛胰岛素的水溶液可产生丁达尔效应 | |
| C. | 结晶牛胰岛素合成之前,应先确定每条链上氨基酸的排列顺序 | |
| D. | 结晶牛胰岛素双链之间通过肽键联接 |
3.在一定温度下将Cl2通入NaOH溶液中,得到ClO-、ClO3-等离子,其物质的量n(mol)随反应时间t(min)的变化如图所示.下列有关说法正确的是( )


| A. | t1时,溶液中Na+、NH4+、CO32-、S2-可以大量共存 | |
| B. | t2时,溶液中含氯微粒浓度大小:c(ClO-)>c(Cl-)>c(ClO3-) | |
| C. | t3时,离子方程式为:4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O | |
| D. | t4时,因c(ClO-)接近于0,所以c(ClO3-)=c(Cl-) |
1. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
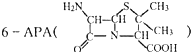 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
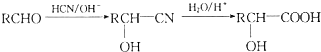
 .
.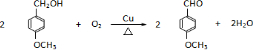 .
. .
.
 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,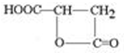 .
.