题目内容
1.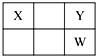 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
分析 短周期主族元素中,W的单质是淡黄色固体,则W为S元素,由X、Y、W在周期表中的相对位置可知,Y为O元素,X为C元素,X、Y、Z、W、Q是原子序数依次增大,所以Q为Cl.其中只有Z是金属,可能为Na、Mg、Al中的一种,然后结合元素的单质及化合物的性质来解答.
解答 解:短周期主族元素中,W的单质是淡黄色固体,则W为S元素,由X、Y、W在周期表中的相对位置可知,Y为O元素,X为C元素,X、Y、Z、W、Q是原子序数依次增大,所以Q为Cl.其中只有Z是金属,可能为Na、Mg、Al中的一种.
A.W的最高价含氧酸为硫酸,而最高价氧化物对应水化物的酸性最强的是高氯酸,故A错误;
B.Z可能为Na、Mg、Al中的一种,若Z为Na与O可以形成两种氧化物,故B错误;
C.非金属性O>S,故S2-的还原性强于O2-,即简单阴离子还原性:Y<W,故C错误;
D.若Z为Al,Z与Q形成的化合物AlCl3为共价化合物,含有共价键,故D正确;
故选:D.
点评 本题考查位置结构性质关系应用,推断元素是解答本题的关键,W为淡黄色固体为突破口,注意把握元素周期表和元素周期律,题目难度不大.

练习册系列答案
相关题目
11.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
| A. | 将水加热煮沸 | B. | 向水中投入一小块金属钠 | ||
| C. | 向水中通入二氧化硫气体 | D. | 向水中加食盐晶体 |
12.下列物质一定属于同系物的是( )
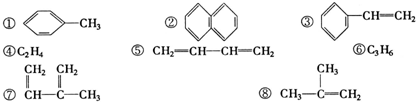

| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑧ | D. | ④和⑧ |
9.下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
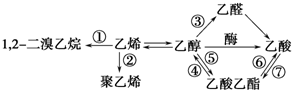

| A. | 反应①是加成反应 | B. | 反应②是加聚反应 | ||
| C. | 反应③是还原反应 | D. | 反应④⑤⑥⑦是取代反应 |
13.如表为六种短周期元素的部分性质:
下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
10.下列离子方程式书写正确的是( )
| A. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 大理石放入稀硝酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铝片插入浓烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
11.化学键的键能是指气态原子间形成1mol化学键时释放的能量.如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ•mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量.一个化学反应一般都有旧化学键的破坏和新化学键的形成.
下表是一些键能数据(KJ•mol-1):
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是化学反应的反应热等于反应物的键能之和与生成物的键能之和的差=185(KJ).
下表是一些键能数据(KJ•mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是化学反应的反应热等于反应物的键能之和与生成物的键能之和的差=185(KJ).
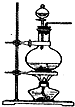 化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.
化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.