题目内容
19.钴(Co)是一种重要的战略金属,钴及其合金广泛应用于电机、机械、化工、航空和航天等领域.钴在化合物中通常以+2、+3的形式存在.(1)写出基态Co原子的价电子排布式3d74s2;
(2)Co的一种氧化物的晶胞如右图所示,则该氧化物的化学式为CoO,在该晶体中与一个氧离子等距离且最近的Co离子所形成的空间构型为正八面体;

(3)Co2+、Co3+都能与CN-形成配位数为6的配离子.CN-中碳原子的杂化方式为sp,1molHCN分子中σ键的数目为2NA;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的4-,该配离子是一种相当强的还原剂,在加热时能与水反应生成3-,写出该反应的离子方程式:2[Co(CN)6]4-+2H2O═2[Co(CN)6]3-+H2↑+2OH-.
分析 (1)Co是27号元素,核外电子数为27,根据构造原理书写核外电子排布式;
(2)根据均摊法计算晶胞中Co、O原子数目,据此书写化学式;以体心的O原子研究,与之最近等距离且最近的Co离子位于面心上;
(3)计算CN-中碳原子的价层电子对数与孤电子对数,据此判断杂化方式;HCN分子中C原子与H原子之间形成C-H单键、与N原子之间形成C≡N三键;
(4)[Co(CN)6]4-具有强还原性,能与水反应生成[Co(CN)6]3-与氢气,根据原子守恒与电荷守恒可知还有OH-生成.
解答 解:(1)Co是27号元素,核外电子数为27,其核外电子排布式为:1s22s22p63s23p63d74s2,价电子排布式为3d74s2,故答案为:3d74s2;
(2)晶胞中Co原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、O原子数目=1+12×$\frac{1}{4}$=4,故化学式为CoO;以体心的O原子研究,与之最近等距离且最近的Co离子位于面心上,Co离子所形成的空间构型为正八面体,
故答案为:CoO;正八面体;
(3)CN-中碳原子的价层电子对数=1+$\frac{4+1-3}{2}$=2、含有1对孤电子对,C原子采取sp杂化方式;HCN分子中C原子与H原子之间形成C-H单键、与N原子之间形成C≡N三键,分子中含有2个σ键,故1molHCN分子中σ键的数目为 2NA,
故答案为:sp;2NA;
(4)[Co(CN)6]4-具有强还原性,能与水反应生成[Co(CN)6]3-与氢气,根据原子守恒与电荷守恒可知还有OH-生成,反应离子方程式为:2[Co(CN)6]4-+2H2O═2[Co(CN)6]3-+H2↑+2OH-,
故答案为:2[Co(CN)6]4-+2H2O═2[Co(CN)6]3-+H2↑+2OH-;
点评 本题考查核外电子排布、杂化方式、化学键、晶胞结构及计算等,难度中等,注意掌握均摊法进行晶胞计算.

 阅读快车系列答案
阅读快车系列答案| A. | 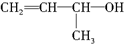 | B. | CH2═CH-CH3 | C. |  | D. | 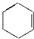 |
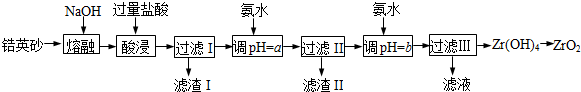
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+.
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表.
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是5.2~6.2;继续加氨水至pH=b时,所发生反应的离子方程式为ZrO2++2NH3•H2O+H2O=Zr(OH)4↓+2NH4+.
(3)向过滤Ⅲ所得滤液中加入CaCO3粉末并加热,得到两种气体.该反应的离子方程式为2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O.
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净.
| A. | 加成反应 | B. | 水解反应 | C. | 氧化反应 | D. | 消去反应 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 将水加热煮沸 | B. | 向水中投入一小块金属钠 | ||
| C. | 向水中通入二氧化硫气体 | D. | 向水中加食盐晶体 |

| A. | 反应①是加成反应 | B. | 反应②是加聚反应 | ||
| C. | 反应③是还原反应 | D. | 反应④⑤⑥⑦是取代反应 |