题目内容
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )| A.反应进行60s时,X、Y、Z的浓度相等 |
| B.反应进行80s时,逆反应速率大于正反应速率 |
| C.以X浓度变化表示的反应速率为0.06mol/(L?min) |
| D.反应进行80s时,Y物质的量浓度为0.03mol/L |
C
试题分析:A.由方程式2X(g)+Y(g)
 Z(g)可知在反应进行60s达到平衡时生成0.3molZ,则消耗0.6molX和0.3mol Y.还有0.4molX;0.7molY; 0.3molZ.因为容器的容积相同,所以物质的量的比就是它们的浓度的比,故反应进行60s时,X、Y、Z的浓度并不相等。错误。B. 反应进行60s时达到平衡,由于外界条件不变,所以80s时,反应仍然处于平衡状态,逆反应速率等于正反应速率。错误。C. 以X浓度变化表示的反应速率为(0.3mol×2)÷10L÷1min=0.06mol/(L?min).正确。D. 当反应进行80s时,反应处于平衡状态。Y物质的量浓度为(1mol-0.3mol)÷10L=0.07mol/L.错误。
Z(g)可知在反应进行60s达到平衡时生成0.3molZ,则消耗0.6molX和0.3mol Y.还有0.4molX;0.7molY; 0.3molZ.因为容器的容积相同,所以物质的量的比就是它们的浓度的比,故反应进行60s时,X、Y、Z的浓度并不相等。错误。B. 反应进行60s时达到平衡,由于外界条件不变,所以80s时,反应仍然处于平衡状态,逆反应速率等于正反应速率。错误。C. 以X浓度变化表示的反应速率为(0.3mol×2)÷10L÷1min=0.06mol/(L?min).正确。D. 当反应进行80s时,反应处于平衡状态。Y物质的量浓度为(1mol-0.3mol)÷10L=0.07mol/L.错误。
练习册系列答案
相关题目
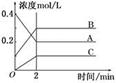
 2B(g)+C(g)
2B(g)+C(g) 2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
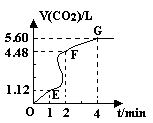 (气体体积均在标准状况下测定)。请回答下列问题:
(气体体积均在标准状况下测定)。请回答下列问题: (3)加入CaCO3的质量为 。
(3)加入CaCO3的质量为 。 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器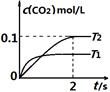
 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
 SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为 pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)= v(A),反应2 min时,A的浓度减少了
v(A),反应2 min时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成,回答下列问题:
mol,有a mol D生成,回答下列问题: