题目内容
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为
 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为| A.υ(NH3)=0.0060 mol/(L·s) |
| B.υ(NO)=0.0040 mol/(L·s) |
| C.υ(O2)=0.0060 mol/(L·s) |
| D.υ(H2O)=0.036 mol/(L·min) |
B
试题分析:根据v=
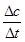 计算v(H2O),再利用速率之比等于化学计量数之比计算各物质表示的反应速率,进行判断。在体积10L的密闭容器中进行,10s后,水蒸气的物质的量增加了0.60mol,其浓度为0.60mol÷10L=0.060mol/L,则v(H2O)=0.060mol/L÷10s=0.006mol?L-1?s-1,A、速率之比等于化学计量数之比,所以v(NH3)=
计算v(H2O),再利用速率之比等于化学计量数之比计算各物质表示的反应速率,进行判断。在体积10L的密闭容器中进行,10s后,水蒸气的物质的量增加了0.60mol,其浓度为0.60mol÷10L=0.060mol/L,则v(H2O)=0.060mol/L÷10s=0.006mol?L-1?s-1,A、速率之比等于化学计量数之比,所以v(NH3)=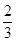 ×0.006mol?L-1?s-1=0.0040mol?L-1?s-1,故A错误;B、速率之比等于化学计量数之比,所以v(NO)=
×0.006mol?L-1?s-1=0.0040mol?L-1?s-1,故A错误;B、速率之比等于化学计量数之比,所以v(NO)=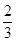 ×0.006mol?L-1?s-1=0.0040mol?L-1?s-1,故B正确;C、速率之比等于化学计量数之比,所以v(O2)=
×0.006mol?L-1?s-1=0.0040mol?L-1?s-1,故B正确;C、速率之比等于化学计量数之比,所以v(O2)= ×0.006mol?L-1?s-1=0.0050mol?L-1?s-1,故C不正确;D、v(H2O)=0.36mol?L-1?min-1,故D错误,故选B。
×0.006mol?L-1?s-1=0.0050mol?L-1?s-1,故C不正确;D、v(H2O)=0.36mol?L-1?min-1,故D错误,故选B。
练习册系列答案
相关题目
 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)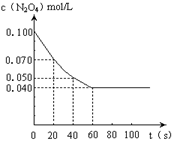
 p C中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
p C中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为 2XY2
2XY2 2X2Y
2X2Y