题目内容
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。
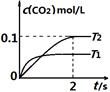
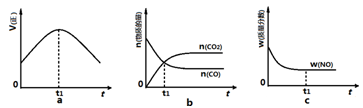
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)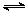 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
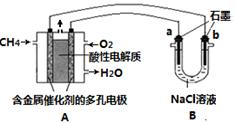
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。


图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)
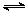 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
(14分)(每空2分)(1)①< ②0.025mol/(L·s) ③c
(2)N2O4(g)+CH4(g)=N2(g)+2H2O(l)+CO2(g) △H=-898.1kJ/mol
(3)①CH4-8e-+2H2O= CO2+8 H+ ②14 ③1.68
(2)N2O4(g)+CH4(g)=N2(g)+2H2O(l)+CO2(g) △H=-898.1kJ/mol
(3)①CH4-8e-+2H2O= CO2+8 H+ ②14 ③1.68
试题分析:(1)①根据化学平衡中“先拐先平”的规律,T1>T2,则温度升高,二氧化碳浓度减小,说明升温平衡逆向移动,所以正向是放热反应△H<0;
②2s内二氧化碳的浓度增加0.1mol/L,则氮气的浓度增加0.05mol/L,所以v (N2)=0.05mol/L/2s=0.025mol/(L·s);
③图a中t1时刻说明正反应速率最大,因为该反应为放热反应,容器为绝热容器,所以开始时相当于给体系升温,温度升高,反应速率加快,但同时升温不利于正反应的进行,所以正反应速率后来又逐渐减小,当正反应速率不再变化时说明达平衡状态,因此t1时刻未达到平衡状态;b图中t1时刻的一氧化碳和二氧化碳的物质的量相等,不能说明t1时刻达到平衡状态;c图中t1时刻NO的质量分数不再变化,说明已达平衡状态,正确,答案选c。
(2)根据盖斯定律,目标方程式=①-②+2×③,所以CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式为N2O4(g)+CH4(g)=N2(g)+2H2O(l)+CO2(g) △H=-898.1kJ/mol
(3)①燃料电池中的负极是燃料发生氧化反应,所以该燃料电池的负极反应式为CH4-8e-+2H2O= CO2+8 H+
②食盐水中的Cl-的物质的量是0.1mol,若按电解食盐水的化学方程式中2NaOH~H2~Cl2,当生成0.1mol氢气时,应生成0.1mol氯气,与题意不符,所以电解食盐水开始是Cl-和H+放电,Cl-放电完毕后是OH-放电,因此溶液中氢氧化钠的物质的量为0.05mol×2=0.1mol,所以c(OH-)=0.1mol/0.1L=1mol/L,溶液pH=14;
③根据②的分析,阳极产生0.05mol的氯气和0.025mol的氧气,所以标准状况下的体积是1.68L。

练习册系列答案
相关题目

 2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是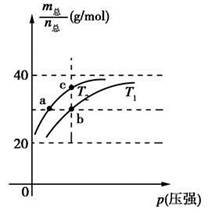
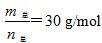 时,n(HF):n[(HF)2]=2:1
时,n(HF):n[(HF)2]=2:1 2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,
2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,
 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( ) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按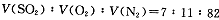 投料,在
投料,在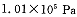 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。
 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。

 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表: