题目内容
3.下列溶液中粒子的物质的量浓度关系一定正确的是( )| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
分析 A、常温下,pH=9的NaHA溶液说明溶液呈碱性,水解程度大于电离程度;
B、根据电荷守恒分析解答;
C、可能氢氧化钠过量,则c(OH-)>c(HCOO-)>c(H+);
D、根据物料守恒分析解答.
解答 解:A、常温下,pH=9的NaHA溶液说明溶液呈碱性,水解程度大于电离程度,所以离子浓度大小为:c(Na+)>c(HA-)>c(H2A)>c(A2-),故A错误;
B、根据电荷守恒,可知c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),所以c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+),故B正确;
C、可能氢氧化钠过量,则c(OH-)>c(HCOO-)>c(H+),所以不一定符合,故C错误;
D、根据物料守恒,可知:c(F-)+c(HF)=$\frac{0.1×V+0.1×V}{2V}$=0.1mol•L-1,故D错误;
故选B.
点评 本题考查了离子浓度的大小,结合盐的水解,电荷的守恒和物料守恒综合分析题中信息,得出合理结论,本题难度不大.

练习册系列答案
相关题目
19.通过反应O2+PtF6=O2PtF6可以制得氧所形成的正价盐,经研究表明该化合物(O2PtF6)中存在阴离子PtF6-.下列说法正确的是( )
| A. | 该化合物含有离子键和共价键 | |
| B. | 1molO2参与该反应时,得到1mol电子 | |
| C. | 该化合物中阳离子与阴离子个数比为2:1 | |
| D. | O2PtF6的熔点可能比O2低 |
14.下列有关化学反应原理的说法不正确的是( )
| A. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 | |
| B. | 过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 | |
| C. | 电解质溶液导电的过程中,一定发生了电解质溶液的电解 | |
| D. | 溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
18.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6,下列说法正确的是( )
| A. | Y元素最高价氧化物对应水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Y>Z>X | |
| C. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 | |
| D. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
8.N、Cu、H、O、S、Mg是常见的六种元素:
(1)Mg位于元素周期表第三周期第IIA族;N与O的基态原子核外未成对电子个数比为
3:2;Cu的基态原子电子排布式为1s22s22p63s23p63d104s1.
(2)用“>”或“<”填空:
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1mol H2SO4放热akJ,则该反应的热化学方程式为Mg3N2(S)+4H2SO4(aq)=3MgSO4(aq)+(NH4)2SO4(aq)△H=-4akJ/mol.
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽).写出该反应的化学方程式,并标出电子转移的方向和数目 .
.
(1)Mg位于元素周期表第三周期第IIA族;N与O的基态原子核外未成对电子个数比为
3:2;Cu的基态原子电子排布式为1s22s22p63s23p63d104s1.
(2)用“>”或“<”填空:
| 碱性: Mg (OH)2> Cu(OH)2 | 第一电离能:O< N | 熔点: MgS< MgO | 稳定性: H2S< H2O |
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽).写出该反应的化学方程式,并标出电子转移的方向和数目
 .
.
15.下列说法错误的是( )
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相对分子质量相等的两种物质,不一定是同分异构体 | |
| D. | 烯烃各同系物含碳的质量分数相等 |
13.有两种气态饱和烃的混合物0.1mol,完全燃烧可得标况下6.72L二氧化碳和0.3mol水,这两种烃可能是( )
| A. | C2H4、C3H6 | B. | C2H4、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
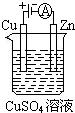 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在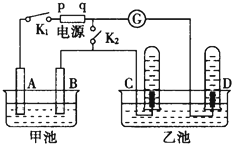 在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:
在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题: