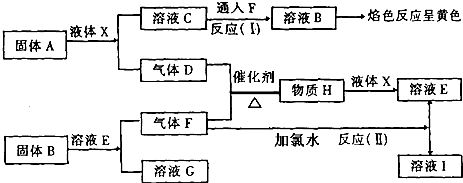
题目内容
13.有两种气态饱和烃的混合物0.1mol,完全燃烧可得标况下6.72L二氧化碳和0.3mol水,这两种烃可能是( )| A. | C2H4、C3H6 | B. | C2H4、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
分析 n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,根据H原子、C原子守恒计算混合物的平均分子组成,可判断烃的组成,以此解答.
解答 解:n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(H2O)=0.3mol,n(H)=0.6mol,故该混合烃的平均分子式为C3H6,
A.若C2H4和C4H6,其平均H原子数目小于6,故A错误;
B.若为C2H4、C4H8,根据平均H原子数目,可知二者物质的量之比为1:1,根据平均碳原子数目,二者物质的量之比也为1:1,故B正确;
C.若为C3H4、C4H8,平均C原子数目为大于3,不可能,故C错误;
D.若为C3H4、C3H6,其平均H原子数目小于6,不可能,故D错误.
故选:B.
点评 本题考查烃混合物分子式确定,为高频考点,难度中等,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

练习册系列答案
相关题目
3.下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
4.关于化学键的下列叙述中,正确的是( )
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 离子化合物中不含共价键 | D. | 共价化合物中不含离子键 |
8.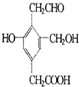 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )| A. | 3:3:2:1 | B. | 6:4:3:2 | C. | 1:1:1:1 | D. | 3:2:2:1 |
18.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 15g甲基所含有的电子数是10NA个 | |
| B. | 1mol苯乙烯中含有的碳、碳双键数为4NA个 | |
| C. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
2.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
| A. | 所含共用电子对数目为$\frac{a}{7+1}$NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$ L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |