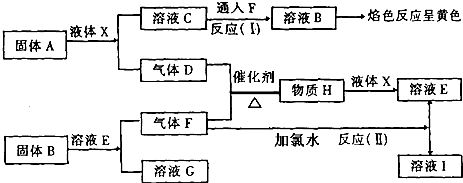
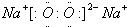题目内容
11. (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.
(2)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.
②组装该电池必须在无水、无氧的条件下进行,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
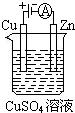
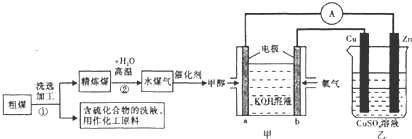
(3)如图是一个电化学过程示意图.
①锌片上发生的电极反应是Cu2++2e-=Cu.
②假设使用Li-SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li-SOCl2电池理论上消耗Li的质量28g.
分析 (1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)根据SOCl2与NaOH溶液反应的生成物确定SOCl2与水反应的生成物,根据与水反应生成物的性质判断反应现象,从而写出与水反应的方程式;
(3)根据类比钠的活泼性判断锂的活泼性,根据锂的活泼性以及SOCl2的性质分析;
(4)①锌片是阴极发生还原反应;②根据转移电子数目相等,分析解答.
解答 解:(1))32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)由NaOH和SOCl2生成Na2SO3和NaCl两种盐知,SOCl2和水生成酸或酸性氧化物,根据原子守恒得,SOCl2和水生成SO2和HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(3)锂和钠是同一主族的元素,性质具有相似性,钠和空气中的氧气、水蒸气反应,所以锂和空气中的氧气、水蒸气也能反应;SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行,
故答案为:锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应;
(4)①锌片是阴极发生还原反应,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②铜为阳极,发生氧化反应,铜片质量变化128g,转移电子的物质的量为$\frac{128g}{64g/mol}$×2=4mol,所以消耗Li的质量质量为4×7=28g,故答案为:28g.
点评 本题以原电池为载体考查了化学电源新型电池,Li-SOCl2电池虽是新型电池,以教材中Cu-Zn原电池的工作原理为依据,判断该电池的正负极及电极反应式.要学会从教材中找出知识点原型进行知识迁移、解决问题的方法.

 全程金卷系列答案
全程金卷系列答案| A. | 甲基的电子式是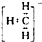 | B. | 硫的原子结构示意图是 | ||
| C. | ${\;}_{8}^{18}$O表示中子数是18的氧原子 | D. | 过氧化氢的结构式是H-O-O-H |
| A. | 明矾与漂白粉常用于自来水的净化与消毒,这两者的作用原理是一样的 | |
| B. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放生石灰 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①CH3OH(l)+3O2(g)=2CO2(g)+4H2O△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol.
(3)C(s)和H2O(g)在一定条件下反应可得到H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/C | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)==1.5mol/L.
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 制硝基苯时温度计水银球在反应液中 | |
| C. | 实验室制乙烯时温度计水银球在反应液中 | |
| D. | 检验溴乙烷中的溴元素时,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,滴加AgNO3溶液 |
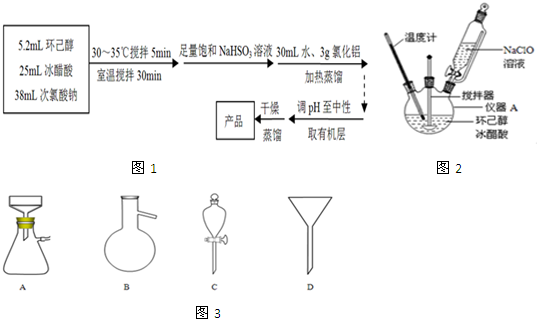

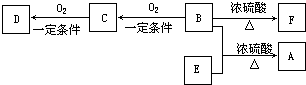 有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得.
有机物A(C10H20O2)具有兰花香味,可用于香皂、洗发香波的芳香剂.A可通过如图所示的转化关系而制得. .
.