题目内容
15.下列说法错误的是( )| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相对分子质量相等的两种物质,不一定是同分异构体 | |
| D. | 烯烃各同系物含碳的质量分数相等 |
分析 结构相似,分子组成上相差1个或者若干个基团的化合物互称为同系物;化合物具有相同分子式,但具有不同结构的物质,为同分异构体;根据同系物的通式可判断出物质含碳量的变化规律.
解答 解:A、C2H6和C4H10根据通式判断为烷烃,所以二者一定是同系物,故A正确;
B、C2H4和C4H8根据通式和结构判断C2H4一定是烯烃,C4H8可以是烯烃也可以是环烷烃,所以不一定是同系物,故B错误;
C、相对分子质量相同的两种物质可以是有机物和无机物,也可以是分子式不同式量相同的有机物,所以不一定是同分异构体,同分异构体是分子式相同,结构不同的化合物,故C正确;
D、烯烃的通式为CnH2n,所以烯烃的各同系物中含碳量相同,故D正确;
故选B.
点评 本题考查了同系物、同分异构体的概念及应用,重点考查各类烃的通式、结构特征、类别判断,注意同分异构体的概念,难度不大.

练习册系列答案
相关题目
11.常温下,下列溶液的离子浓度关系正确的是( )
| A. | pH=4的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-4mol/L | |
| B. | pH=x的CH3COOH溶液100mL,稀释10倍后pH=y,x-y>1 | |
| C. | pH=2的NaHC2O4溶液与pH=12的NaOH溶液以任意比混合,混合液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | pH相同的①CH3COONa、②Na2CO3 、③NaClO三种溶液中c(Na+):①>②>③ |
6.日本的核泄漏引起了人们对核能的恐慌,也加剧了人类对化石燃料的依赖,化石燃料特别是煤的使用不会加剧环境污染,工业上常把煤进行汽化、液化处理,使煤变成清洁能源,煤的一种转化流程图如图:
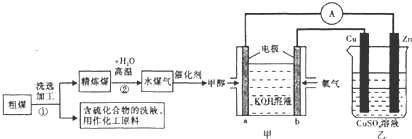
(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①CH3OH(l)+3O2(g)=2CO2(g)+4H2O△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol.
(3)C(s)和H2O(g)在一定条件下反应可得到H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
①实验2条件下平衡常数K=0.75;若实验2中分离出1molH2O(g),则H2O(g)的转化率将增大(填“增大、减小、不变”);
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)==1.5mol/L.

(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①CH3OH(l)+3O2(g)=2CO2(g)+4H2O△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol.
(3)C(s)和H2O(g)在一定条件下反应可得到H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/C | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)==1.5mol/L.
3.下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
20.下列相关实验的操作或结论正确的是( )
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 制硝基苯时温度计水银球在反应液中 | |
| C. | 实验室制乙烯时温度计水银球在反应液中 | |
| D. | 检验溴乙烷中的溴元素时,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,滴加AgNO3溶液 |
4.关于化学键的下列叙述中,正确的是( )
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 离子化合物中不含共价键 | D. | 共价化合物中不含离子键 |
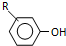 $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$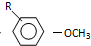 $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$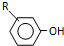
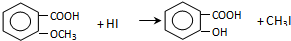 .
.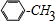 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$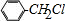 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.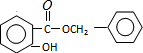 .
. (或
(或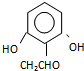 ).
).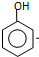 $\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$
$\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$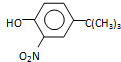 反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为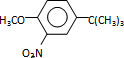 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.