题目内容
【题目】现有常温下的四种溶液(如下表):
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH =11 | pH =11 | C=0.002mol/L | C=0.002mol/L |
下列有关叙述中正确的是
A. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
B. 在④、②两种溶液等体积混合,所得溶液pH=3
C. 四种溶液由水电离出氢离子的浓度从大到小的顺序是③>①>②>④
D. 将①、④两种溶液等体积混合,溶液中c(OH-) >c(H+ )
【答案】D
【解析】①②都是碱性溶液,加水稀释pH都减小,但是氨水是弱碱,减小的慢,氢氧化钠是强碱,减小的快,所以pH:①>②>7。③④加水稀释10倍以后,分别为浓度均为0.0002mol/L的醋酸和盐酸溶液,因为醋酸是弱酸只能电离一部分,盐酸却能完全电离,所以7>③>④。由上,分别加水稀释10倍,四种溶液的pH:①>②>③>④,选项A错误。在④、②两种溶液等体积混合,所得溶液![]() ,所以pH>3,选项B错误。①②两个溶液中溶质电离的氢氧根离子浓度相等,都是0.001mol/L,所以对于水的电离的抑制是相同的,水电离的氢离子实际都是1×10-11mol/L。醋酸是弱酸,0.002mol/L的醋酸电离出来的氢离子浓度一定小于0.001mol/L,所以对于水的电离的抑制最小。盐酸完全电离,所以0.002mol/L的盐酸电离出来的氢离子浓度为0.002mol/L,所以对于水的电离的抑制最强。由上所述,四种溶液由水电离出氢离子的浓度从大到小的顺序是③>①=②>④,选项C错误。pH =11的氨水中,NH3·H2O的浓度应该远大于0.001mol/L(因为NH3·H2O只能电离很少一部分),所以也远大于0.002mol/L的盐酸,两者等体积混合,NH3·H2O会过量很多,所以溶液显碱性,c(OH-) >c(H+ ),选项D正确。
,所以pH>3,选项B错误。①②两个溶液中溶质电离的氢氧根离子浓度相等,都是0.001mol/L,所以对于水的电离的抑制是相同的,水电离的氢离子实际都是1×10-11mol/L。醋酸是弱酸,0.002mol/L的醋酸电离出来的氢离子浓度一定小于0.001mol/L,所以对于水的电离的抑制最小。盐酸完全电离,所以0.002mol/L的盐酸电离出来的氢离子浓度为0.002mol/L,所以对于水的电离的抑制最强。由上所述,四种溶液由水电离出氢离子的浓度从大到小的顺序是③>①=②>④,选项C错误。pH =11的氨水中,NH3·H2O的浓度应该远大于0.001mol/L(因为NH3·H2O只能电离很少一部分),所以也远大于0.002mol/L的盐酸,两者等体积混合,NH3·H2O会过量很多,所以溶液显碱性,c(OH-) >c(H+ ),选项D正确。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中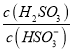 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。