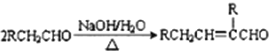题目内容
【题目】反应2Na2O2+2CO2=2Na2CO3+O2中,氧化产物是
A.Na2O2B.CO2C.Na2CO3D.O2
【答案】D
【解析】
反应2Na2O2+2CO2=2Na2CO3+O2中,Na2O2→O2氧元素化合价由-1升高为0,发生氧化反应,所以O2是该反应的氧化产物,故选D。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为:
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol·L-1·s-1
B. 其他条件不变,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
C. T1温度下的平衡常数为K1=125,1000s时转化率为50%
D. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3