题目内容
3.已知A、B、C、D、E为原子序数依次增大的五种短周期元素.其中A与D、B与E同主族,C元素的最外层电子数是内层电子数的3倍,D元素在地壳中的含量仅次于氧,D的单质是良好的半导体材料,E元素的最高正价与最低负价的代数和为2.请回答:(1)E元素的氢化物是极性分子(填“极性”或“非极性”),电子式是
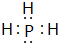 .
.(2)A、B、C三种元素形成的氢化物的熔点由高到低的顺序是H2O>NH3>CH4.(用化学式表示)
(3)B、D、E三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HNO3>H3PO4>H2SiO3.(同上)
(4)工业上用A单质制备D单质的化学方程式是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,C元素的最外层电子数是内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D元素在地壳中的含量仅次于氧,D的单质是良好的半导体材料,则D为Si;A与D同主族,则A为碳元素;E元素的最高正价与最低负价的代数和为2,原子序数大于Si,则E为P元素;B与E同主族,则B为N元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,C元素的最外层电子数是内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D元素在地壳中的含量仅次于氧,D的单质是良好的半导体材料,则D为Si;A与D同主族,则A为碳元素;E元素的最高正价与最低负价的代数和为2,原子序数大于Si,则E为P元素;B与E同主族,则B为N元素.
(1)E元素的氢化物为PH3,与氨气结构相似,为三角锥形结构,分子中正负电荷重心不重合,属于极性分子,电子式是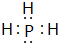 ,故答案为:极性;
,故答案为:极性;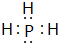 ;
;
(2)A、B、C三种元素形成的氢化物分别为CH4、NH3、H2O,常温下CH4、NH3为气体,而H2O为液态,故H2O的熔点最高,NH3分子之间存在氢键,熔点高于CH4,故熔点H2O>NH3>CH4,故答案为:H2O>NH3>CH4;
(3)B、D、E三种元素的最高价氧化物的水化物分别为:HNO3、H2SiO3、H3PO4,非金属性N>P>Si,故酸性由强到弱的顺序是:HNO3>H3PO4>H2SiO3,
故答案为:HNO3>H3PO4>H2SiO3;
(4)工业上用碳单质与二氧化硅反应制备Si单质,化学方程式是:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意氢键为物质性质的元素,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | +4价氧化物都能与氢氧化钠溶液反应 | |
| B. | 单质在加热时都能与氧气反应 | |
| C. | 氧化物都能溶于水生成相应的酸 | |
| D. | 碳和硅两种元素都有能导电的单质 |
| A. | CO32-和HCO3- | B. | CO32-,HCO3-和S2- | ||
| C. | CO32-,HCO3-,S2-,CH3COO- | D. | 全部 |
| A. | n-3 | B. | n-1 | C. | n+5 | D. | n+2 |
| A. | 把少量液溴、白磷放在水下 | |
| B. | 把铝片、镁条放置在不密封的纸盒里 | |
| C. | 把汽油、溴水放在带橡皮塞的玻璃试剂瓶中 | |
| D. | 把硝酸、硝酸银放在配有磨口玻璃塞的棕色瓶中 |
| A. | H2→H2O | B. | H+→H2 | C. | HClO→HCl | D. | ClO3-→Cl- |
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
| A. | 除去NaHCO3溶液中少量的Na2CO3:通入过量的CO2 | |
| B. | 除去MgCl2溶液中少量的AlCl3:加入过量氢氧化钠溶液,过滤,用蒸馏水洗涤沉淀后用稀盐酸溶解沉淀 | |
| C. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| D. | 用盐酸除去AgCl中少量的Ag2CO3 |