题目内容
11. 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).Ⅰ.【查阅资料】
①Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4.
③Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸.
Ⅱ.【实验装置】
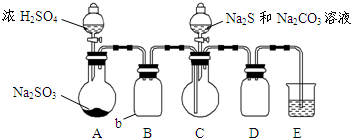
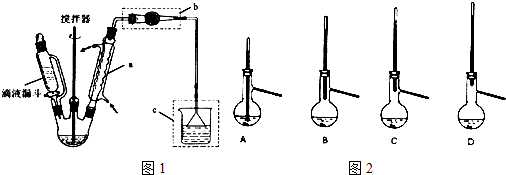
如图所示(省略夹持装置):
Ⅲ.【实验步骤】
①如图示加入试剂.
②先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4.C中发生反应:Na2CO3+2Na2S+4SO2→3Na2S2O3+CO2
③待Na2S和Na2CO3完全消耗后,结束反应.C中溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥得到Na2S2O3•5H2O的粗产品.
(1)加入试剂之前须进行的操作是检查装置的气密性;b瓶的名称是广口瓶,作用是作安全瓶,防止倒吸.
(2)A中不可用稀硫酸的原因为:生成的二氧化硫在稀硫酸中溶解性比较大,不易溢出.
(3)E中的试剂可以选用b(选填序号).
a.稀H2SO4b.NaOH溶液c.饱和NaHSO3溶液d.Na2CO3溶液
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案:
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,取沉淀,加入足量稀盐酸,当沉淀未完全溶解,并有刺激性气味的气体产生(填实验现象),则可确定产品中含有Na2SO3和Na2SO4.
(5)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤②进行了改进,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液.
(6)所制得的粗产品可以通过重结晶方法进一步提纯得到纯Na2S2O3•5H2O.
分析 (1)加入试剂之前须进行的操作是检查装置的气密性,仪器b的名称是广口瓶,作用主要是作安全瓶,防止倒吸;
(2)根据生成的二氧化硫溶解性比较大,不易溢出来分析;
(3)E装置目的是吸收剩余的二氧化硫,因为与碳酸钠反应没有与氢氧化钠溶液反应充分,与稀H2SO4和饱和NaHSO3溶液不反应;
(4)根据亚硫酸钡溶解于稀盐酸并且有刺激性气味的气体产生,硫酸钡不溶解于稀盐酸来分析;
(5)根据亚硫酸钠易被氧化生成硫酸钠分析;
(6)根据重结晶的适用范围分析.
解答 解:(1)装置搭好以后,加入试剂之前须进行的操作是检查装置的气密性,仪器b的名称是广口瓶,因为生成的二氧化硫易溶于水溶液,所以要防止倒吸,则b瓶的作用是作安全瓶,防止倒吸;故答案为:检查装置的气密性;广口瓶;作安全瓶,防止倒吸;
(2)因为稀硫酸与亚硫酸钠反应生成的二氧化硫在稀硫酸中溶解性比较大,不易溢出来,而浓硫酸浓度大又具有吸水性,所以生成的二氧化硫在浓硫酸里溶解性较小,易溢出,故答案为:生成的二氧化硫在稀硫酸中溶解性比较大,不易溢出;
(3)E中的试剂是NaOH溶液,目的是吸收剩余的二氧化硫,因为二氧化硫与碳酸钠反应没有与氢氧化钠溶液反应充分,与稀H2SO4和饱和NaHSO3溶液不反应,
故选:b;
(4)因为BaSO3难溶于水,可溶于稀盐酸并且有刺激性气味的气体产生,硫酸钡不溶解于稀盐酸,所以当沉淀未完全溶解,并有刺激性气味的气体产生,说明固体中既有硫酸钡又有亚硫酸钡,则可确定产品中含有Na2SO3和Na2SO4;故答案为:当沉淀未完全溶解,并有刺激性气味的气体产生;
(5)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
(6)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,故答案为:重结晶.
点评 本题以某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O)为载体,考查了物质的分离提纯、检验、设计优化等,综合性较强.

 口算题天天练系列答案
口算题天天练系列答案 NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )| A. | 常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应 | |
| B. | 工业上利用澄清石灰水与Cl2反应来制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 电解含酚酞的NaCl溶液,由于OH-往阳极移动,故阳极先变红 |
| A. | 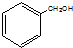 酚类-OH | B. | 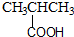 酯-COOH | C. | 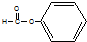 醛类-CHO | D. | CH3-O-CH3 醚类 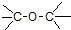 |
| A. | NaOH | B. | H2O | C. | KCl | D. | CaO |

 .
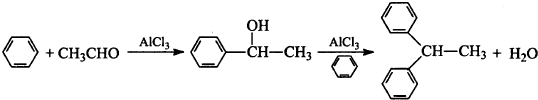
. +NaOH
+NaOH  +NaBr.
+NaBr. .
.

 HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).
HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).