题目内容
19.Atropic酸(H)是某些具有消炎、镇痛作用药物的中间体,其一种合成路线如下:
(1)G中含氧官能团的名称是羟基和羧基;反应1为加成反应,则B的结构简式是
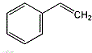 .
.(2)C-D的化学方程式是
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr.(3)反应2的反应类型为加成反应,反应3的反应条件为浓硫酸、加热.
(4)下列说法正确的是ad.
a.B中所有原子可能在同一平面上
b.合成路线中所涉及的有机物均为芳香族化合物
c.一定条件下1mol有机物H最多能与5mol He发生反应
d.G能发生取代、加成、消去、氧化、缩聚等反应
(5)化合物G有多种同分异构体,其中同时满足下列条件:①能发生水解反应和银镜反应;
②能与FeCl,发生显色反应;③核磁共振氢谱只有4个吸收峰的同分异构体的结构简式是
 .
.
分析 根据题中各物质转化关系,苯与乙炔发生加成反应生成B为: ,由E的结构可反推得D为
,由E的结构可反推得D为 ,B在双氧水的条件下与溴化钾化氢发生加成反应得C,C在碱性条件下水解得D,所以C为
,B在双氧水的条件下与溴化钾化氢发生加成反应得C,C在碱性条件下水解得D,所以C为 ,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H,据此答题.
,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H,据此答题.
解答 解:根据题中各物质转化关系,苯与乙炔发生加成反应生成B为: ,由E的结构可反推得D为
,由E的结构可反推得D为 ,B在双氧水的条件下与溴化钾化氢发生加成反应得C,C在碱性条件下水解得D,所以C为
,B在双氧水的条件下与溴化钾化氢发生加成反应得C,C在碱性条件下水解得D,所以C为 ,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H,
,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H,
(1)根据G的结构简式可知,G中含氧官能团的名称是羟基和羧基,B为: ,
,
故答案为:羟基和羧基; ;
;
(2)C-D的化学方程式是 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr,
+NaBr,
故答案为: +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr;
+NaBr;
(3)根据上面的分析可知,反应2的反应类型为加成反应,反应3是醇有消去反应,所以反应条件为浓硫酸、加热,
故答案为:加成反应;浓硫酸、加热;
(4)a.B为: ,B中有苯环结构和碳碳双键结构,所以B中所有原子可能在同一平面上,故a正确;
,B中有苯环结构和碳碳双键结构,所以B中所有原子可能在同一平面上,故a正确;
b.合成路线中所涉及的有机物乙炔不含苯环,不是芳香族化合物,故b错误;
c.根据H的结构可知,一定条件下1mol有机物H最多能与4mol He发生反应,故c错误;
d.根据G的结构简式可知,G中有羟基和羧基以及苯环,所以G能发生取代、加成、消去、氧化、缩聚等反应,故d正确,
故选ad;
(5)化合物G的同分异构体,满足下列条件:①能发生水解反应和银镜反应,说明有甲酸酯,②能与FeCl3,发生显色反应,说明有酚羟基,③核磁共振氢谱只有4个吸收峰的同分异构体的结构简式为 ,
,
故答案为: .
.
点评 本题以有机物的合成考查结构与性质、有机反应类型、化学方程式、同分异构体的书写等,是对学生综合能力的考查,注意利用有机物的结构进行分析解答,同分异构的书写为易错点,难度中等.

 阅读快车系列答案
阅读快车系列答案NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)
| A. | 把电能转变为化学能的装置 | |
| B. | 活泼金属做正极,不活泼金属或非金属做负极 | |
| C. | 外电路中电子从负极流向正极 | |
| D. | 正极发生氧化反应 |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的最高价氧化物对应的水化物的碱性:Y比X弱 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于浓氨水 | |
| D. | 一定条件下,X单质可以将W单质从其氢化物中置换出来 |

 和
和

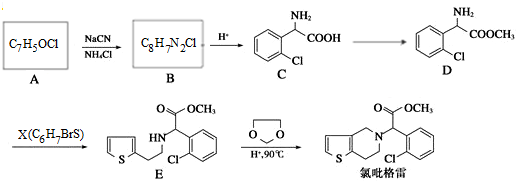
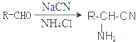 ,②
,②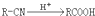
 +CH3OH $→_{△}^{浓硫酸}$
+CH3OH $→_{△}^{浓硫酸}$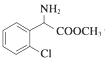 +H2O,反应类型取代反应.
+H2O,反应类型取代反应.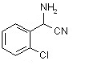 ,X
,X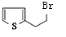 .
.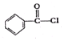 .
. .
. ,设计一条由乙烯、甲醇为有机原料制备化合物
,设计一条由乙烯、甲醇为有机原料制备化合物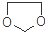 的合成路线流程图,无机试剂任选.(合成路线常用的表反应试剂A反应条件B…反应试剂反应条件目标产物示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图,无机试剂任选.(合成路线常用的表反应试剂A反应条件B…反应试剂反应条件目标产物示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)

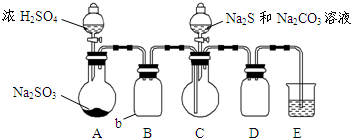 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).