题目内容
20.用“>”或“<”回答下列问题①元素的非金属性越强,其对应最高氧化物水化物的酸性越强;
②元素的金属性越强,其对应最高氧化物水化物的碱性越强;
③元素的非金属性越强,其对应气态氢化物的稳定性越稳定;
④酸性:H2SiO3<H3PO4;气态氢化物稳定性:H2S<HCl.
分析 ①元素的非金属性越强,其对应最高氧化物水化物的酸性越强;
②元素的金属性越强,其对应最高氧化物水化物的碱性越强;
③元素的非金属性越强,其对应气态氢化物的稳定性越稳定;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,氢化物的稳定性越强.
解答 解:①元素的非金属性越强,其对应最高氧化物水化物的酸电离氢离子越容易,导致其最高价氧化物的水化物酸性越强,故答案为:强;
②元素的金属性越强,其对应最高氧化物水化物的碱电离出氢氧根离子越容易,所以碱性越强,故答案为:强;
③元素的非金属性越强,其对应气态氢化物中非金属元素吸引电子能力越强,导致其氢化物的稳定性越强,故答案为:非金属;稳定;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,氢化物的稳定性越强,非金属性Si<P、S<Cl,所以酸性:H2SiO3<H3PO4;气态氢化物稳定性:H2S<HCl,故答案为:<;<.
点评 本题考查元素周期律,侧重考查非金属性、非金属性强弱判断,明确元素周期律内涵是解本题关键,知道非金属性与其最高价氧化物的水化物酸性、氢化物的稳定性关系,题目难度不大.

练习册系列答案
相关题目
10.实验室用溴化钠、浓硫酸和醇制备溴乙烷(CH3CH2Br)和1-溴丁烷(CH3CH2CH2CH2Br)的反应原理如下:
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)
8.下列有关原电池的叙述中正确的是( )
| A. | 把电能转变为化学能的装置 | |
| B. | 活泼金属做正极,不活泼金属或非金属做负极 | |
| C. | 外电路中电子从负极流向正极 | |
| D. | 正极发生氧化反应 |
15.下列变化属于物理变化的是( )
| A. | 氧气在放电条件下变成臭氧 | B. | 加热胆矾成白色无水硫酸铜 | ||
| C. | 漂白的草帽久置空气中变黄 | D. | 氢氧化铁胶体加入硫酸镁产生沉淀 |
5.下列说法中,不符合ⅦA元素性质特征的是( )
| A. | ⅦA族元素形成的单质的熔点随元素原子序数增大而升高 | |
| B. | ⅦA族元素易形成-1价离子 | |
| C. | 最高价氧化物的水化物显酸性 | |
| D. | 从上到下气态氢化物的稳定性依次增强 |
12.已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀)→3Fe(NO3)3+NO↑+2H2O,现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
(1)放出4480mL气体时,消耗金属的质量为16.8g
(2)稀硝酸的浓度为4mol•L-1
(3)计算原混合物中铁和铜的物质的量比为2:1
(4)加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
(2)稀硝酸的浓度为4mol•L-1
(3)计算原混合物中铁和铜的物质的量比为2:1
(4)加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
9.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的最高价氧化物对应的水化物的碱性:Y比X弱 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于浓氨水 | |
| D. | 一定条件下,X单质可以将W单质从其氢化物中置换出来 |
10.描述CH3-CH=CH-C≡C-CH3分子结构的下列叙述中,正确的是( )
| A. | 6个碳原子有可能都在一条直线上 | B. | 6个碳原子不可能都在一条直线上 | ||
| C. | 6个碳原子有可能都在同一平面上 | D. | 6个碳原子不可能都在同一平面上 |
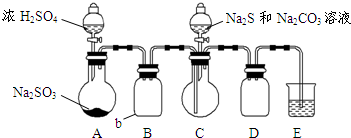 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).