题目内容
8.下列有关晶体的说法①依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体;
②由原子直接构成的晶体就是原子晶体;
③分子晶体的堆积均采取分子密堆积;
④SiF4、NaF、MgF2 三种晶体的熔点依次升高;
⑤金属键只存在于金属晶体中;
⑥离子键只存在于离子晶体中;
⑦H2O的性质非常稳定,原因在于分子之间存在氢键;
⑧SO2和SiO2晶体在熔化时破坏的作用力不相同.其中一定正确的有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 ①依据构成微粒与微粒间的作用可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体;
②由原子直接构成的晶体就是原子晶体,也有可能是分子晶体,如:稀有气体;
③分子晶体的堆积不一定是分子密堆积,如冰晶体中存在氢键,不是分子密堆积;
④NaF和MgF2为离子晶体,SiF4为分子晶体;
⑤在配合物(多聚型)中,为达到18e-,金属与金属间以共价键相连,亦称金属键;
⑥离子键只存在于离子晶体中;
⑦H2O的性质非常稳定,原因在于H-O键的键能较大;
⑧SO2是分子晶体,熔化时破坏的是分子间作用力;SiO2是原子晶体,熔化时破坏的是共价键.
解答 解:①依据构成微粒与微粒间的作用可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体,不是依据粒子的堆积方式分类,故①错误;
②由原子直接构成的晶体就是原子晶体,也有可能是分子晶体,如:稀有气体,故②错误;
③分子晶体的堆积不一定是分子密堆积,如冰晶体中存在氢键,不是分子密堆积,故③错误;
④NaF和MgF2为离子晶体,镁离子带2个单位正电荷,离子晶体中离子所带电荷越多熔点越高,SiF4为分子晶体熔点较低,故晶体的熔点的大小关系为:MgF2>NaF>SiF4,故④正确;
⑤金属键主要在于金属晶体中,在配合物(多聚型)中,为达到18e-,金属与金属间以共价键相连,亦称金属键,故⑤错误;
⑥离子间通过离子键结合形成的晶体为离子晶体,所以离子键只存在于离子晶体中,故⑥正确;
⑦H2O的性质非常稳定,原因在于H-O键的键能较大,与氢键无关,故⑦错误;
⑧SO2是分子晶体,熔化时破坏的是分子间作用力;SiO2是原子晶体,熔化时破坏的是共价键,故⑧正确,
故选A.
点评 本题考查四种晶体类型与结构、性质等,侧重于基础知识的考查,题目难度不大,注意基础知识的掌握与晶体中的特殊性.

| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙 酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| C | 乙醇(乙酸) | 无 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
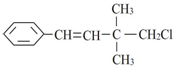 ,关于该有机物,下列叙述不正确的是( )
,关于该有机物,下列叙述不正确的是( )| A. | 所有碳原子不可能在同一平面上 | |
| B. | 属于卤代烃 | |
| C. | 分子式为C12H15Cl | |
| D. | 能发生加成反应、取代反应、加聚反应、消去反应 |
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | 只有在原子中,质子数与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 氧和臭氧互为同位素 |
| A. | 乙醇和甲醇 | B. | 邻羟基苯甲醛与对羟基苯甲醛 | ||
| C. | 对羟基苯甲酸与邻羟基苯甲酸 | D. | H2O和H2S |
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)

 和
和
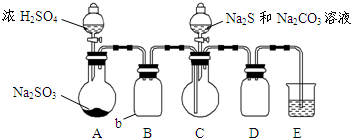 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).