题目内容
2. NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )| A. | 常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应 | |
| B. | 工业上利用澄清石灰水与Cl2反应来制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 电解含酚酞的NaCl溶液,由于OH-往阳极移动,故阳极先变红 |
分析 A、铁能在氯气中燃烧生成棕黄色的烟FeCl3;
B、工业上利用氯气和石灰乳反应来制取漂白粉;
C、NH3极易溶于水,而CO2在水中的溶解度不大,据此分析;
D、电解NaCl溶液,阳极上Cl-放电,阴极上来自于水的H+放电,故OH-在阴极生成.
解答 解:A、常温下,铁与干燥的氯气不反应,但在点燃的条件下两者能反应:3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故A错误;
B、由于Ca(OH)2的水溶性较差,在水中的溶解度不大,故工业上利用氯气和石灰乳反应来制取漂白粉,而不是利用氯气和澄清石灰水反应来制取漂白粉,故B错误;
C、NH3极易溶于水,而CO2在水中的溶解度不大,故应先向饱和NaC1溶液中通入足量NH3,再通入足量CO2,可析出NaHCO3晶体,故C正确;
D、电解NaCl溶液,阳极上Cl-放电,阴极上来自于水的H+放电,故OH-在阴极生成,故阴极先变红,故D错误.
故选C.
点评 本题综合考查了铁与氯气的反应条件、漂白粉的制取、侯氏制碱法和电解饱和食盐水中两极上的离子放电情况,难度不大,掌握好基础是解题关键.

练习册系列答案
相关题目
20.下列化合物的沸点比较,前者低于后者的是( )
| A. | 乙醇和甲醇 | B. | 邻羟基苯甲醛与对羟基苯甲醛 | ||
| C. | 对羟基苯甲酸与邻羟基苯甲酸 | D. | H2O和H2S |
10.实验室用溴化钠、浓硫酸和醇制备溴乙烷(CH3CH2Br)和1-溴丁烷(CH3CH2CH2CH2Br)的反应原理如下:
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)
12.已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀)→3Fe(NO3)3+NO↑+2H2O,现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
(1)放出4480mL气体时,消耗金属的质量为16.8g
(2)稀硝酸的浓度为4mol•L-1
(3)计算原混合物中铁和铜的物质的量比为2:1
(4)加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
(2)稀硝酸的浓度为4mol•L-1
(3)计算原混合物中铁和铜的物质的量比为2:1
(4)加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.


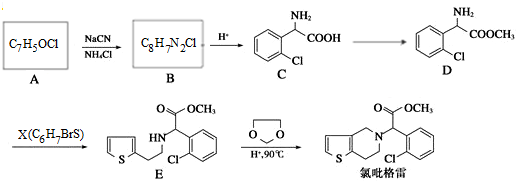
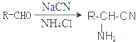 ,②
,②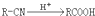
 +CH3OH $→_{△}^{浓硫酸}$
+CH3OH $→_{△}^{浓硫酸}$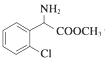 +H2O,反应类型取代反应.
+H2O,反应类型取代反应.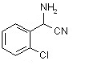 ,X
,X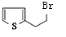 .
.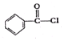 .
. .
. ,设计一条由乙烯、甲醇为有机原料制备化合物
,设计一条由乙烯、甲醇为有机原料制备化合物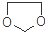 的合成路线流程图,无机试剂任选.(合成路线常用的表反应试剂A反应条件B…反应试剂反应条件目标产物示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图,无机试剂任选.(合成路线常用的表反应试剂A反应条件B…反应试剂反应条件目标产物示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物) 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).