题目内容
5.下列说法正确的是( )| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 电子层数越多的原子半径越大 | |
| C. | 同周期非金属氧化物对应的水化物酸性从左到右依次增强 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的沸点也最高 |
分析 A.不同周期不能比较,如Ca的金属性比Na的强;
B.原子半径由电子层数、核电荷数等因素共同决定;
C.非金属性越强,最高价氧化物对应的水化物的酸性越强;
D.ⅥA族中,O的非金属性最强,且水中含氢键;
解答 解:A.Ca的金属性比Na的强,应为同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,故A错误;
B.原子核对核外电子的吸引,核外电子多,相应的核内质子数也多,静电作用力增强影响原子的半径,电子层数多少只是影响原子半径的因素之一,原子电子层数越多,对应的原子半径不一定大,如K比I少一电子层,但半径K比I大,故B错误;
C.非金属性越强,最高价氧化物对应的水化物的酸性越强,则同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强,而HClO、亚硫酸等为弱酸,但不是最高价含氧酸,故C错误;
D.ⅥA族中,O的非金属性最强,且水中含氢键,则ⅥA族元素的氢化物中稳定性最好的,其沸点也最高,故D正确;
故选D.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置及性质变化规律为解答的关键,B为该题的易错点,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
15.一定条件下反应A(s)+3B(g)?2C(g)在10L的密闭容器中进行,测得2min内,A的物质的量由20mol减小到8mol,则下列说法中正确的是( )
| A. | 用反应物A表示该反应的反应速率为0.6 mol•L-1•min-1 | |
| B. | 用反应物B表示该反应的反应速率为1.8 mol•L-1•min-1 | |
| C. | 反应达到平衡时$\frac{2}{3}$v(B)正=v(C)逆 | |
| D. | 升高温度可加快正反应的速率,同时降低逆反应的速率 |
13.已知断裂1mol共价键所需要吸收的能量分别为:H-H:436kJ,I-I:151kJ,H-I:299kJ,下列对H2(g)+I2(g)?2HI(g)的反类型判断错误的是( )
| A. | 放热反应 | B. | 吸热反应 | C. | 氧化还原反应 | D. | 可逆反应 |
17.现已知O3分子为V字形结构,O3在水中的溶解度和O2比较要大或小( )
| A. | O3在水中的溶解度和O2一样 | B. | O3在水中的溶解度比O2小 | ||
| C. | O3在水中的溶解度比O2要大 | D. | 没办法比较 |
14.下列化合中,即有离子键又有共价键的是( )
| A. | H2O | B. | CaO | C. | NaCl | D. | NaOH |
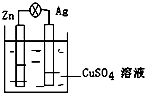 在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出.
在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出. .
.