题目内容
6.下列萃取与分液结合进行的操作(用CCl4作萃取剂,从碘水中萃取碘)中错误的是( )| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
分析 A.四氯化碳和水不互溶,据此解答;
B.使分液漏斗内外空气相通保证液体顺利流出,据此解答;
C.下层液体从下口流出,据此解答;
D.分液漏斗不能保存液体,据此解答.
解答 解:A.四氯化碳和水不互溶,可以用四氯化碳萃取碘水中的碘,故A正确;
B.使分液漏斗内外空气相通保证液体顺利流出,故B正确;
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以免两种液体相互污染,故C正确;
D.分液漏斗不能保存液体,应在细口瓶中保存,故D错误,
故选D.
点评 本题考查分液,难度不大,注意分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以免两种液体相互污染.

练习册系列答案
相关题目
2.下列图示与对应的叙述相符的( )
| A. | 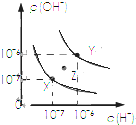 表示不同条件下水的电离平衡曲线,图中各点温度:X>Z>Y | |
| B. | 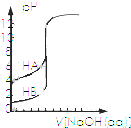 表示浓度相同的两种一元酸分别用0.1 mol/L NaOH溶液滴定曲线,酸性:HA>HB | |
| C. | 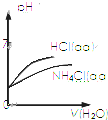 表示pH相同的NH4Cl溶液和HCl溶液分别加同体积水稀释二者pH的变化曲线 | |
| D. | 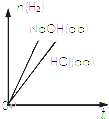 表示向等体积、等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝粉,产生H2的物质的量随时间的变化曲线 |
3. 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )| A. | P1<P2<P3<P4 | |
| B. | T1<T2<T3<T4 | |
| C. | T4和P1状态下,H2的平衡转化率为8/9 | |
| D. | 甲醇的物质的量分数越小,反应的平衡常数越小 |
20.近年来,乳酸成为研究热点之一,以乳酸为原料制成的高分子材料具有生物兼容性.已知乳酸的结构简式为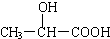 ,下列物质中能与乳酸反应的是( )
,下列物质中能与乳酸反应的是( )
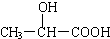 ,下列物质中能与乳酸反应的是( )
,下列物质中能与乳酸反应的是( )| A. | 金属铁 | B. | NH4Cl溶液 | C. | 乙烷 | D. | 苯 |
18.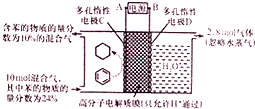 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
16.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
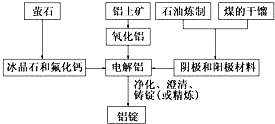
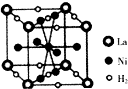 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.