题目内容
7.在加热固体NH4Al(SO4)2•12H2O时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4) 3,下列判断正确的是( )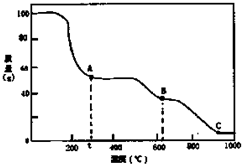
| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |
分析 A、根据0℃→t℃有没有新物质生成判断;
B、根据B点物质为Al2(SO4)3,继续升温再分解生成C点的产物判断;
C、根据A→B发生的反应为2NH4Al(SO4)2$\frac{\underline{\;\;△\;\;}}{\;}$Al2(SO4)3+2NH3+H2SO4判断;
D、Al2(SO4)3能够净水,其原理为:Al3++3H2O?Al(OH)3+3H+,据此判断.
解答 解:A、因为t℃生成A,又A点物质为NH4Al(SO4)2为新物质,则0℃→t℃的过程为NH4Al(SO4)2•12H2O失去结晶水生成NH4Al(SO4)2是化学变化,故A错误;
B、B点物质为Al2(SO4)3,升温在加热分解则在C点生成氧化铝,所以C点物质是工业上冶炼铝的原料,故B正确;
C、A→B发生的反应为2NH4Al(SO4)2$\frac{\underline{\;\;△\;\;}}{\;}$Al2(SO4)3+2NH3+H2SO4,所以除了生成Al2(SO4)3和NH3两种,还有硫酸,故C错误;
D、Al2(SO4)3能够净水,其原理为:Al3++3H2O?Al(OH)3+3H+,生成的氢氧化铝具有吸附性可以吸附水中悬浮的杂质,故D错误;
故选:B.
点评 本题考查根据化学式的计算,正确判断不同温度下所得到固体成分是解本题关键,同时考查学生分析问题能力、计算能力,题目难度中等.

练习册系列答案
相关题目
3. 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )| A. | P1<P2<P3<P4 | |
| B. | T1<T2<T3<T4 | |
| C. | T4和P1状态下,H2的平衡转化率为8/9 | |
| D. | 甲醇的物质的量分数越小,反应的平衡常数越小 |
18.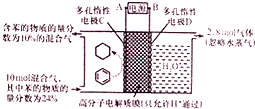 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
12.下列说法不正确的是( )
| A. | 石油主要成分都是碳氢化合物 | |
| B. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| C. | 天然气和沼气的主要成分是甲烷 | |
| D. | 75%(体积分数)的乙醇溶液常用于医疗消毒 |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| B. | 2.8g[CH2 CH2]n 中含有的碳原子数为0.2NA | |
| C. | 1mol苯分子中含有C=C双键数为3NA | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3NA |
16.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
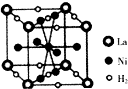 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
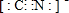
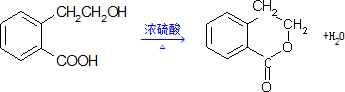 .
. .
.