题目内容
2.现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+转化为Mg(OH)2,并使与Al3+分开,至少需要4mol•L-1的NaOH溶液的体积为( )| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |
分析 根据电荷守恒计算出混合溶液中溶液中n(Al3+),MgCl2和AlCl3的混合溶液与氢氧化钠溶液的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH)=n(Cl)+n(Al),由此计算即可.
解答 解:溶液中n(Cl-)=0.2L×1.3mol/L=0.26mol,
溶液中n(Mg2+)=0.2mol/L×0.2L=0.04mol.
所以溶液中n(Al3+)=$\frac{0.26mol-0.04mol×2}{3}$=0.06mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,
反应后溶液为NaCl、NaAlO2的混合液,
由原子守恒可知n(NaOH)=n(Na)=n(Cl)+n(Al)=0.26mol+0.06mol=0.32mol,
所以至少需要4mol/L氢氧化钠溶液的体积为$\frac{0.32mol}{4mol/L}$=0.08L=80mL.
故选:D.
点评 本题考查计算,利用原子守恒,简化解题,关键在于清楚反应后溶液为NaCl、NaAlO2的混合液.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
8. 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
①食盐水 ②KNO3溶液 ③乙醇 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水.
 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )①食盐水 ②KNO3溶液 ③乙醇 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水.
| A. | ①③⑤ | B. | ②⑥ | C. | ③⑤ | D. | ①②④ |
6.由丙烷、乙烯、乙炔组成的混合气体,完全燃烧后生成CO2和H2O的物质的量相同,原混合气体中三种烃的体积之比不可能是( )
| A. | 1:2:1 | B. | 3:2:3 | C. | 2:5:2 | D. | 1:2:3 |
13.氨基呈碱性,氨基酸呈两性,把甘氨酸(氨基乙酸)放入一定pH的溶液中,所得溶液中不能同时大量存在的微粒是( )
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
11.下列分子式只能表示一种物质的是( )
| A. | C3H7Cl | B. | CH2Cl2 | C. | C4H10 | D. | C2H6O |
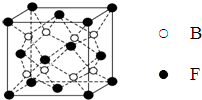 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)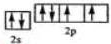 ;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族
;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族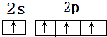 ,不符合能量最低原理原理.
,不符合能量最低原理原理.

 .
.