题目内容
8. 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )①食盐水 ②KNO3溶液 ③乙醇 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水.
| A. | ①③⑤ | B. | ②⑥ | C. | ③⑤ | D. | ①②④ |
分析 为使该反应顺利进行,加入的物质能增大溶液体积但不影响锌和稀硫酸的反应,据此分析解答.
解答 解:①食盐水和锌、稀硫酸都不反应,所以不影响锌和稀硫酸的反应,故选;
②加入KNO3溶液,相当于溶液中有稀硝酸,稀硝酸和锌反应生成氮氧化物而不是氢气,产生杂质,故不选;
③乙醇和锌、稀硫酸都不反应,不影响锌和稀硫酸的反应,故选;
④Na2CO3溶液和稀硫酸反应生成二氧化碳,所以影响锌和稀硫酸反应,故不选;
⑤CCl4和锌、稀硫酸都不反应,所以不影响锌和稀硫酸的反应,故选;
⑥浓氨水和稀硫酸发生中和反应,影响锌和稀硫酸的反应,故不选;
故选A.
点评 本题考查物质之间的反应,正确理解该题目目的及物质的性质是解本题关键,易错选项是②,注意隐含条件,题目难度不大.

练习册系列答案
相关题目
18.以下有关实验操作的叙述不正确的是( )
| A. | 利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出 | |
| B. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| C. | 用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3次后方可使用 |
19.下表列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式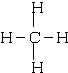 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
16.下列说法中正确的是( )
| A. | 球棍模型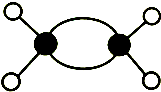 表示的有机物是乙烯 表示的有机物是乙烯 | |
| B. | 电子式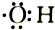 可以表示羟基,也可以表示氢氧根 可以表示羟基,也可以表示氢氧根 | |
| C. | 有机物 的分子式为C6H8O2 的分子式为C6H8O2 | |
| D. | 结构简式(CH3)2CHOH:可以表示1-丙醇,也可以表示2-丙醇 |
3.分子式为C6H12O2且与NaHCO3反应放出CO2的有机化合物有(不考虑立体结构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
20.已知,金刚石的燃烧热为395kJ/mol,下表是部分化学键的键能数据,下列选项中正确的是:
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金刚石的能量一定比1molCO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
17.将CH3CHO(易溶于水,沸点为20.8℃的液体)和CH3COOH分离的正确方法是 …( )
| A. | 加热蒸馏 | |
| B. | 加入Na2CO3后,通过萃取的方法分离 | |
| C. | 先加入烧碱溶液,之后蒸出乙醛,再加入浓H2SO4,蒸出乙酸 | |
| D. | 和Na反应后进行分离 |
2.现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+转化为Mg(OH)2,并使与Al3+分开,至少需要4mol•L-1的NaOH溶液的体积为( )
| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |