题目内容
9.难溶电解质的溶解平衡属于化学平衡的一种.(1)已知H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-.常温下CaA的饱和溶液中存在以下平衡CaA(s)?Ca2+(aq)+A2-(aq)△H>0,则该饱和溶液呈碱性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将减小(填“增大”、“减小”或“不变”,下同);滴加少量浓盐酸c(Ca2+)增大.
(2)含有Cr2O${\;}_{7}^{2-}$的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O${\;}_{7}^{2-}$.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.欲使10L该废水中的Cr2O${\;}_{7}^{2-}$完全转化为Cr3+,则理论上需要加入83.4 g FeSO4•7H2O.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6 mol•L-1(已知;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
分析 (1)由H2A的电离方程式可知H2A为弱酸,CaA水解呈碱性,CaA(s)?Ca2+(aq)+A2-(aq)△H>0为吸热过程,降温平衡逆向移动,加入盐酸,可生成HA-、H2A;
(2)依据浓度计算10L废水中Cr2O72-的物质的量,结合氧化还原反应电子守恒的定量关系计算硫酸亚铁晶体质量;结合溶度积常数计算.
解答 解:(1)由H2A的电离方程式可知H2A为弱酸,CaA水解呈碱性,CaA(s)?Ca2+(aq)+A2-(aq)△H>0为吸热过程,降温平衡逆向移动,加入盐酸,可生成HA-、H2A,则促进CaA的溶解,c(Ca2+)增大,
故答案为:碱;减小;增大;
(2)某工厂废水中含5.00×10-3 mol•L-1的Cr2O72-,n(Cr2O72-)=10L×5.00×10-3mol/L=5.00×10-2mol,
依据氧化还原反应离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,得到n(Fe2+)=5.00×10-2mol×6=0.3mol,
需要FeSO4•7H2O蒸馏=0.3mol×278g/mol=83.4g,
若处理后的废水中残留的c(Fe3+)=2×10-13mol•L-1,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25mol/L,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.0×10-31 ,c(Cr3+)=3×10-6mol•L-1,
故答案为:83.4;3×10-6.
点评 本题考查较综合,涉及难溶物的溶解平衡、氧化还原反应的计算等知识点,难度较大,根据温度、电解质溶液对难溶物性质的影响和守恒的角度解答即可.

| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
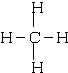 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金刚石的能量一定比1molCO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
| A. | 加热蒸馏 | |
| B. | 加入Na2CO3后,通过萃取的方法分离 | |
| C. | 先加入烧碱溶液,之后蒸出乙醛,再加入浓H2SO4,蒸出乙酸 | |
| D. | 和Na反应后进行分离 |
| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |
| A. | 氨基酸、多肽、蛋白质都具有两性 | |
| B. | 利用油脂在酸性条件下水解,可以产生甘油和肥皂 | |
| C. | 淀粉与纤维素分子式都为(C6H10O5)n,但结构不同,所以它们互为同分异构体 | |
| D. | 饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析 |
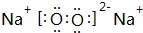 、
、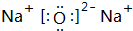 .
. .
.