题目内容
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是____________。
②已知:
2Cu(s)+1/2O2(g)═Cu2O(s)△H=-169kJmol-1,
C(s)+1/2O2(g)═CO(g)△H=-110.5kJmol-1,
Cu(s)+1/2O2(g)═2CuO(s)△H=-157kJmol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu20(s)+CO(g); △H=____________kJ/mol。
(2)氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4.
该反应每转移3mol电子,生成CuH的物质的量为____________。
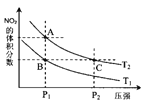
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。
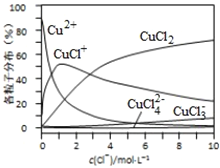
①当c(Cl-)=9molL-1时,溶液中主要的3种含铜物种浓度大小关系为____________。
②在c(Cl-)=1molL-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为____________(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为____________,(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3L-3)
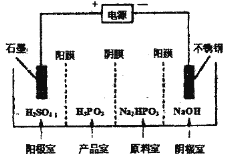
②电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为____________。
【答案】(1)①反应不易控制,易还原产生Cu②+34.5
(2)1mol;(3)①c(CuCl2)>c(CuCl+)>c(CuCl3-);②CuCl+═Cu2++Cl-;
(4)①5×10-9;②HPO32-+2H+=H3PO3
【解析】
试题分析:(1)①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是反应不易控制,易还原产生Cu,故答案为反应不易控制,易还原产生Cu;
②已知A.2Cu(s)+1/2O2(g)═Cu2O(s)△H=-169kJmol-1,
B.C(s)+1/2O2(g)═CO(g)△H=-110.5kJmol-1,
C.Cu(s)+1/2O2(g)═2CuO(s)△H=-157kJmol-1
据盖斯定律,a+b-2c可得:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H =(-169kJmol-1)+(-110.5kJmol-1) -(-314kJmol-1) =+34.5kJ/mol,故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJ/mol
(2)从反应4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4分析,Cu从+2价变成+1,4molCu得到4mol电子,H从+1价变成-1价,4mol-1价的H得到8mol电子,共得电子12mol,P从+1价变成+5价,3molP共失电子12mol。每生成4molCuH转移电子12mol,所以,转移电子3mol时应生成CuH1mol,故答案为:1mol;
(3)①在c(Cl-)=9molL-1处,做一条平行与纵轴的虚线,可见溶液中主要含铜物种浓度大小关系为:c(CuCl2)>c(CuCl+)>c(CuCl3-)>c(Cu2+)>c(CuCl42-),故答案为:c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1molL-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,加入硝酸银后,氯离子浓度下降,方程式为:CuCl+═Cu2++Cl-,故答案为:CuCl+═Cu2++Cl-;
(4)①铜离子水解离子反应为Cu2++2H2O![]() Cu(OH)2+2H+,Ksp=c(Cu2+)×c2(OH-)=2.0×10-20mol3L-3,则K=
Cu(OH)2+2H+,Ksp=c(Cu2+)×c2(OH-)=2.0×10-20mol3L-3,则K=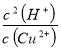 =
=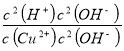 =
=![]() =
=![]() =5×10-9,故答案为:5×10-9;
=5×10-9,故答案为:5×10-9;
②阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑,产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO3

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案