题目内容
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
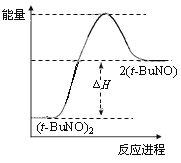
①CO(g)+2H2(g)![]() CH3OH(g)△H1=—99kJ.mol-1,
CH3OH(g)△H1=—99kJ.mol-1,
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)写出CO2的结构式__________。
(2)由上述数据计算出△H3=kJ.mol-1
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度T1、T2对反应的影响,下列正确的是__________(填序号)

①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tAmol/(L·min)
②该反应在T1时的平衡常数比T2时的小
③当生成1mol甲醇的同时,生成1molCO2,说明反应达到平衡
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;该温度条件下,反应平衡常数为__________(计算出结果)
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸性,负极的电极反应式为__________。
【答案】(1)O=C=O;(2)+41;(3)③④;(4)3:4;4/27(0.15)(5)CH3OH+6e-+H2O=CO2↑+6H+
【解析】
试题分析:(1)CO2属于直线型分子,结构式为O=C=O,故答案为:O=C=O;
(2)①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ/mol
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ/mol
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ/mol-(-99kJ/mol)=+41kJ/mol,故答案为:+41;
(3)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2![]() CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大;①v(CH3OH)=
CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大;①v(CH3OH)=![]() =
=![]() mol/(Lmin),故①错误;②正反应为放热反应,根据题给图象分析可知,T2先达到平衡则T2>T1,升高温度,平衡向逆反应方向移动,该反应在T1时的平衡常数比T2时的大,故②错误;③当生成1mol甲醇的同时,生成1molCO2,说明正逆反应速率相等,说明反应达到平衡,故③正确;④处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故n(H2)与n(CH3OH)增大,故④正确;故答案为:③④;
mol/(Lmin),故①错误;②正反应为放热反应,根据题给图象分析可知,T2先达到平衡则T2>T1,升高温度,平衡向逆反应方向移动,该反应在T1时的平衡常数比T2时的大,故②错误;③当生成1mol甲醇的同时,生成1molCO2,说明正逆反应速率相等,说明反应达到平衡,故③正确;④处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故n(H2)与n(CH3OH)增大,故④正确;故答案为:③④;
(4)由化学平衡的三段模式法计算可知,
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol/L)1300
变化0.51.50.50.5
平衡0.51.50.50.5
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=(0.5+1.5+0.5+0.5):(1+3)=3:4,
品红常数K=![]() =
=![]() ,故答案为:3:4;
,故答案为:3:4;![]() 。
。
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸时,负极的电极反应式为CH3OH+6e-+H2O=CO2↑+6H+,故答案为:CH3OH+6e-+H2O=CO2↑+6H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1).HNO3与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
Ⅰ | 1 ﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1 ﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1 ﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
制备NO气体最适宜的是: ,理由是: .
(2).兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:
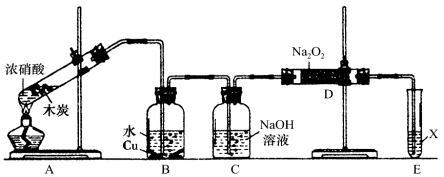
①组装好仪器后,必须进行的一项操作是:_________________。
②推测B中可以观察到的主要现象是:______;C装置的作用是: 。
③装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是:_____。可以通过适当改进,不产生Y物质,请你提出改进方法: _。
④E装置的实验目的是: 。