题目内容
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式 。
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。

①298K时,该反应的平衡常数为________。
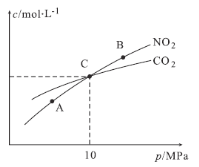
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。

a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,
则此时V(正) V(逆)(填“>”、“<”或“=”)。
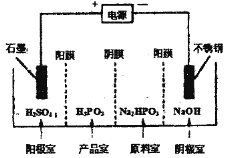
 (3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①水的电离程度最大的是 ;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数
K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是
。
【答案】(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550kJ·mol-1 (2)①6.67 L ·mol-1 ②d ③<(3)①b ②d ③c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】
试题分析:(1)1 g燃料液态偏二甲肼(CH3)2N-NH2完全燃烧释放出的能量为42.5kJ,则1mol完全燃烧释放出的能量为42.5kJ/g×60g/mol=2550kJ·mol-1 ,根据题给信息和热化学方程式的书写原则知,室温下液态偏二甲肼和液态四氧化二氮反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550kJ·mol-1。
(2)①根据题给图像知,298k时,N2O4的平衡浓度为0.6mol/L,N2O4的浓度为NO2的2倍,NO2的平衡浓度为0.3mol/L,该反应的平衡常数K=[N2O4]/[NO2]2=0.6/0.32=6.67 L ·mol-1。
② a.A、C两点的的温度相同,P2>P1,则反应速率:A<C,a项错误;b.由图象可知,在B、C两点时NO2的体积分数相等,气体的平均相对分子质量:B=C,b项错误;c.A、C两点的温度相同,压强:P2>P1,压强增大,容器的体积减小,NO2的浓度增大,则气体的颜色:A浅,C深,c项错误;d.该反应是放热反应,升高温度,平衡逆向移动,NO2的体积分数增大,则由状态B到状态A,可以用加热的方法,d项正确;答案选d。
③反应在298K进行,达到平衡时,c(N2O4)=0.6mol/L,c(NO2)=0.3mol/L,若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,c(NO2)=0.3mol/L,c(N2O4)=0.6mol/L,则由于物质的浓度不变,但是该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,即平衡逆向移动所以V(正)< V(逆);
(3)向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,发生的反应依次为:H++OH-![]() H2O、NH4++ OH-
H2O、NH4++ OH-![]() NH3·H2O。
NH3·H2O。
①当氢离子恰好完全反应时,溶液为硫酸钠和硫酸铵的混合物,水的电离程度最大,结合图像知,水的电离程度最大的是b;
②Kb(NH3·H2O)=c(NH4+)c(OH-)/c(NH3·H2O),c(NH4+)与c(NH3·H2O)相等时,其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值,结合题给图像知是d;
③由图像知,c点溶液呈中性,溶液为硫酸钠、硫酸铵和一水合氨的混合液,各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。

 星级口算天天练系列答案
星级口算天天练系列答案