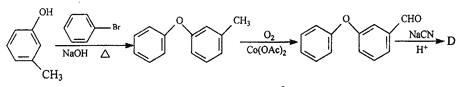
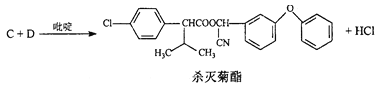
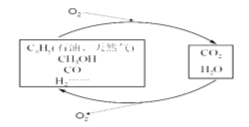
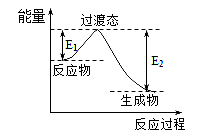
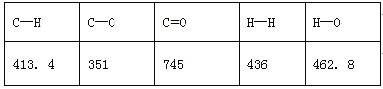
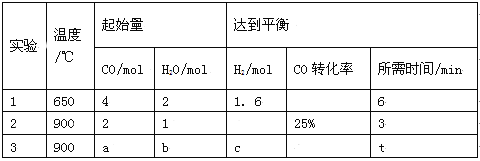
题目内容
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
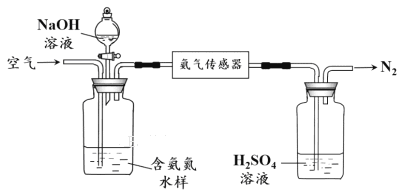
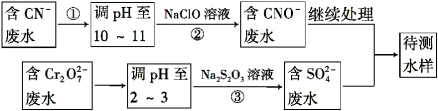
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
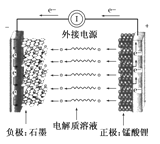
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
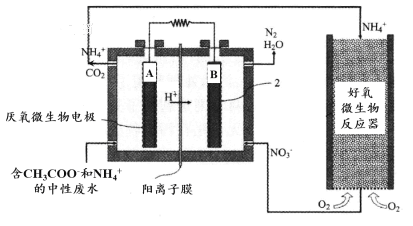
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
【答案】(1)①N2+ 3H2![]() 2NH3 ②4NH3 + 5O2
2NH3 ②4NH3 + 5O2![]() 4NO + 6H2O
4NO + 6H2O
(2)①c(OH-)增大,使NH4++ OH-![]() NH3·H2O
NH3·H2O![]() NH3+ H2O平衡正向移动,利于生成氨气,被空气吹出②3.4
NH3+ H2O平衡正向移动,利于生成氨气,被空气吹出②3.4
(3)①CH3COO-- 8e-+ 2H2O ="==" 2CO2+ 7H+,②NH4+在好氧微生物反应器中转化为NO3-:NH4++ 2O2="==" NO3- + 2H++ H2O;
NO3-在MFC电池正极转化为N2:2NO3- +12H++ 10e- ="==" N2 + 6H2O (2分)
【解析】试题分析:(1)①工业合成氨是利用氮气和氢气催化剂作用下高温高压反应生成氨气,反应的化学方程式为:N2+3H2![]() 2NH3;
2NH3;
②氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用是c(OH-)增大,使NH4++OH-NH3H2ONH3+H2O平衡正向移动,利于生成氨气,被空气吹出;
②将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,依据氮元素守恒2NH3~N2~6e-,
2NH3~N2~6e-,
2 6
n 6×10-4mol/L
n=2×10-4mol/L;水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L;
(3)①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质,则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-═N2+6H2O;
②NH4+在好氧微生物反应器中转化为NO3-,NH4++2O2═NO3-+2H++H2O,硝酸根离子在原电池正极发生还原反应生成氮气,2NO3-+12H++10e-═N2+6H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(1)设计该实验方案的目的是:探究同周期元素的__________________________。
(2)实验①的现象是 ,反应的化学方程式是 。
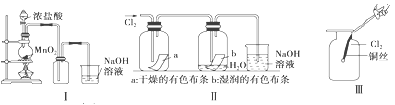
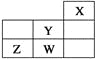
【实验二】 为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图。
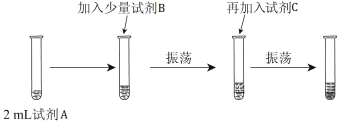
(3)试剂A是 ;试剂B是 ;试剂C是 。
(4)试剂C在实验中所起的作用是 ,加入C振荡、静置后看到的现象是: 。以上反应可以证明Cl2的非金属性_______(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:_______________。