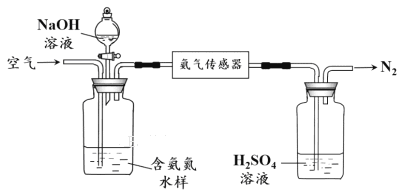
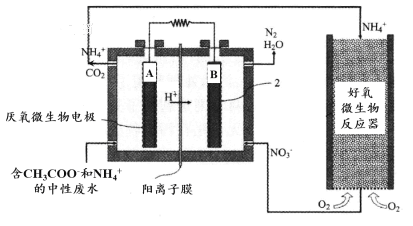
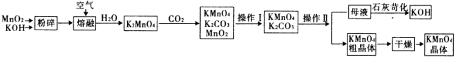
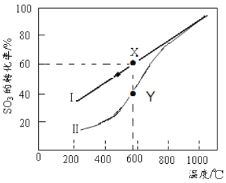
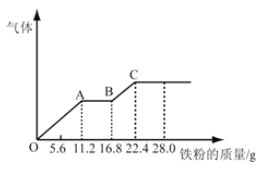
题目内容
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如表所示。下列说法中,正确的是( )
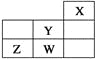
A. W的最高价氧化物对应的水化物是强酸
B. Y的原子半径在同周期主族元素中最大
C. 还原性:W->Z2-
D. Z的气态氢化物的稳定性在同主族元素中最强
【答案】A
【解析】试题分析:根据元素在周期表制得位置关系可知,X为He元素,Y为F元素,W为Cl元素,Z为S元素。A.Cl的非金属性较强,最高价氧化物对应的水化物是强酸,故A正确;B.同一周期,从左到右,原子半径逐渐减小,F的原子半径在同周期主族元素中最小,故B错误;C.元素的非金属性越强,对应离子的还原性越弱,还原性:Cl-<S2-,故C错误;D.元素的非金属性越强,气态氢化物的稳定性越强,S的气态氢化物的稳定性在同主族元素中小于H2O,故D错误;故选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目