题目内容
【题目】通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
(1)在酸式介质中,负极反应的物质为 ,正极反应的物质为 ,酸式电池的电极反应:
负极: ,正极: 。
电解质溶液pH的变化 (填“变大”,“变小”,“不变”)。
(2)在碱式介质中,碱式电池的电极反应:
负极: ,正极: 。
电解质溶液pH的变化 (填“变大”,“变小”,“不变”)。
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是________。
A.太阳光催化分解水制氢气比电解水气氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4)纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
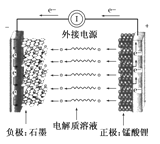
①该电池放电时负极反应式为_________________。
②放电时每转移3 mol电子,正极有________ mol K2FeO4被还原。
锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位。
电池反应式为:Li1-xMnO4+Lix ![]() LiMnO4,下列有关说法不正确的是________。
LiMnO4,下列有关说法不正确的是________。
A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-===LiMnO4
B.放电过程中,石墨没有得失电子
C.该电池也能在KOH溶液的环境中正常工作
D.充电时电池上标有“-”的电极应与外接电源的负极相连
【答案】(1)H2;O2;2H2-4e-=4H+;O2+4e-+4H+=2H2O;变大
(2)2H2-4e-+4OH-=2H2O;O2+4e-+2H2O=4OH-;变小
(3)C
(4)Zn-2e-+2OH-═Zn(OH)2;1
(5)C
【解析】
试题分析:(1)在酸性氢氧燃料电池中,石墨作电极,负极是氢气失电子生成氢离子,电极反应为2H2-4e-=4H+;正极是氧气得电子生成氢氧根离子,生成的氢氧根离子结合氢离子生成水,电极反应为O2+4e-+4H+=2H2O,由于正负极消耗与生成的氢离子等量,所以氢离子的总量不变,而总电极反应式为2H2+O2=2H2O,水的总量增加,氢离子浓度减小,pH变大;
(2)在碱式介质中,氢气在负极失去电子生成氢离子,氢离子结合氢氧根离子生成水,电极反应式为2H2-4e-+4OH-=2H2O;氧气在正极得电子生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-,由于正负极消耗与生成的氢氧根离子等量,所以氢氧根离子的总量不变,而总电极反应式为2H2+O2=2H2O,水的总量增加,氢氧根浓度减小,pH变小;
(3)A、电解获得H2消耗较多的能量,而在催化剂作用下利用太阳能来分解H2O获得H2更为科学,A正确;B、氢氧燃料电池产物H2O无污染,能有效保护环境,B正确;C、以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式分别为:H2-2e-=2H+,H2-2e-+2OH-=H2O,不相同,C错误;D、以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式均为2H2+O2=2H2O,D正确,答案选C。
(4)①放电时,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-+2OH-═Zn(OH)2;
②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3,所以每转移3 mol电子,正极有1molK2FeO4被还原;
(5)A、根据总反应式可知Li失去电子,电池负极反应式为:xLi-xe-═xLi+,由总反应式减去负极反应式可得放电时的正极反应式为Li1-xMnO4+xLi++xe-===LiMnO4,A正确;B、放电过程中,根据总反应式Li1-xMnO4+Lix ![]() LiMnO4可判断石墨没有电子得失,B正确;C、Li能与KOH溶液中的H2O反应,导致电池无法正常工作,C错误;D、充电过程是放电的逆向过程,外界电源的负极提供的电子使原电池负极获得电子发生还原反应,所以标有“-”的电极应与外接电源的负极相连,D正确,答案选C。.
LiMnO4可判断石墨没有电子得失,B正确;C、Li能与KOH溶液中的H2O反应,导致电池无法正常工作,C错误;D、充电过程是放电的逆向过程,外界电源的负极提供的电子使原电池负极获得电子发生还原反应,所以标有“-”的电极应与外接电源的负极相连,D正确,答案选C。.

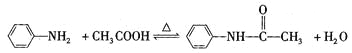
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、乙酰苯胺的制备原理为
实验参数
名称 | 相对分 | 性状 | 密度(g/mL) | 沸点( | 溶解性 | |
苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
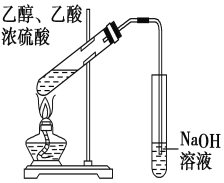
实验装置如图所示(部分仪器及夹持装置已略去)。
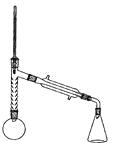
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。②苯胺易被氧化。
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105![]() 左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品。
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼。将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是_____________________。
(2)从化学平衡的角度分析,控制温度计的温度在105![]() 左右的原因是______________。
左右的原因是______________。
(3)通过_____________可判断反应基本完成、
(4)步骤1加热可用_____________(填“水浴”或“油浴”)。
(5)洗涤乙酰苯胺粗品最合适的方法是__________________(填字母)。
A.用少量冷水洗
B.用少量热水洗
C.先用冷水洗,再用热水洗
D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,______________,再将滤液冷却结晶。
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是____________(小数点后保留两位数字。)