题目内容
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体碳酸氢钠,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成氧化钠和两种无污染的气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
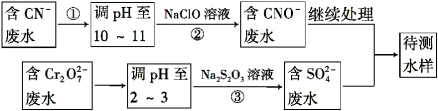
① 上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
② 步骤②反应无气体放出,该反应的离子方程式为_______________________;
③ 步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为 ___________;
④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入amol FeSO4·7H2O,下列结论正确的是 。
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
【答案】
(1)CN-+H2O![]() HCN+OH-
HCN+OH-
(2)NaCN+H2O2+H2O==NaHCO3+NH3↑
(3)3NaCN+5NaNO2==3CO2↑+4N2↑+4Na2O
(4)①d;②CN-+ClO-==CNO-+Cl- ;③3S2O32- +4Cr2O72- +26H+==6SO42-+8Cr3++13H2O;④D
【解析】
试题分析:(1)氰化钠易发生水解产生氰化氢,方程式为CN-+H2OHCN+OH-。
故答案为:CN-+H2OHCN+OH-;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠,方程式为NaCN+H2O2+H2O═NaHCO3+NH3↑。
故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,反应的方程式为
3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O。
故答案为:3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O;
(4)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-
的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样。
①从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,需加还原剂还原,故采用方法为氧化-还原法。
故答案为:d;
②步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-。
故答案为:CN-+ClO-═CNO-+Cl-;
③每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O。
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
④处理1mol Cr2O72-,需加入a mol FeSO47H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成![]() mol FeⅡ[FexⅢCr(2-x)Ⅲ]O4,根据铁原子守恒得amol=
mol FeⅡ[FexⅢCr(2-x)Ⅲ]O4,根据铁原子守恒得amol=![]() mol①,该反应中得失电子数相等,1mol×2×3=
mol①,该反应中得失电子数相等,1mol×2×3=![]() mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10。
mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10。
故答案为:D。