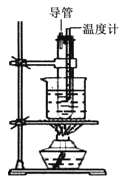
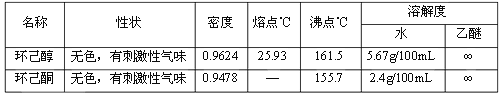
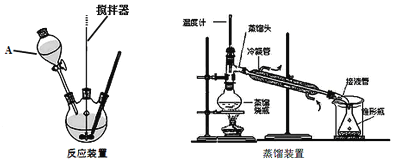
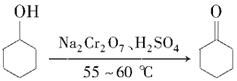��Ŀ����
����Ŀ������a mol/L ��NaX��b mol/L��NaY��������Һ������˵����ȷ����
A. ��a=b��c(X��)= c(Y��)+ c(HY)����HXΪǿ��
B. ��a=b��pH(NaX)>pH(NaY),��c(X��)+ c(OH��)> c(Y��)+ c(OH��)
C. ��a>b��c(X��)= c(Y��)��������HX>HY
D. ������Һ�������ϣ���c(Na+)="(a+b)" mol/L(���Ի�Ϲ����е�����仯)
���𰸡�A
�����������������A����a=b����c(X-)=c(Y-)+c(HY)��˵��HX��ȫ���룬������˵��HXΪǿ�ᣬ��A ��ȷ��B����a=b��pH(NaX)��pH(NaY)�����ݵ���غ��c(Na+)+c(H+)=c(X-)+c(OH-)��c(Na+)+c(H+)=c(Y-)+c(OH-)�����������غ��������Һ��c(Na+)��ȣ�������Һ��PH֪��X-��ˮ��̶ȴ���Y-������NaX��������Ũ��С��NaY������c(X-)+c(OH-)��c(Y-)+c(OH-)����B����C����a��b��c(X-)=c(Y-)��˵��X-��ˮ��̶ȴ���Y-���������ˮ��̶�Խ������Ӧ�������Խ����������HX��HY����C����D��������Һ�������ϣ������Ӳ�ˮ�⣬����Һ�������һ����������c(Na+)=![]() mol/L����D����ѡA��
mol/L����D����ѡA��

 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�