题目内容
【题目】下列说法不正确的是( )

A. 稳定性:HBr<HI<Hat
B. 酸性:H3PO4<H2SO4<HClO4
C. 原子半径:Sn>As>S
D. 表中,元素Pb的金属性最强
【答案】A
【解析】
A.同主族元素从上到下元素的非金属性逐渐降低,则非金属性:Br>I>At,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HAt <HI<HBr,故A错误;
B.同周期元素从左到右元素的非金属性之间增强,则非金属性:Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H3PO4<H2SO4<HClO4,故B正确;
C.同周期元素从左到右原子半径逐渐减小,则原子半径:Si>S;Ge>As。原子核外电子层数越多,半径越大,Sn> Ge > Si 。则原子半径:Sn>As>S,故C正确;
D.同主族元素从上到下元素的金属性逐渐增强,同周期元素从左到右元素的金属性逐渐减弱,故表中元素Pb的金属性最强,故D正确;
答案选A。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】根据下表所示化学反应与数据关系:
化学反应 | 平衡常数 | 温度 | |
973 K | 1 173 K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
请回答:
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有________(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
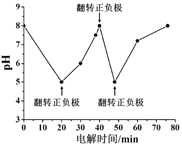
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
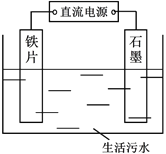
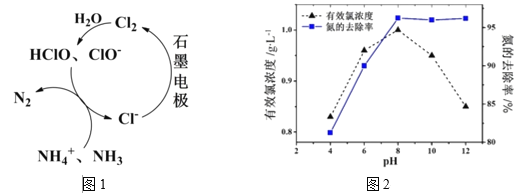
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为 ,则
,则![]() 的结构式为_________。
的结构式为_________。
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:

已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
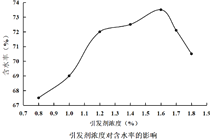
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:

则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。